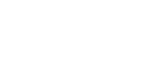Article added / Artikel hinzugefügt 01.10.2021
Generally Articles and Discussions about Osteosarcoma in Dogs
→ Evaluations of phylogenetic proximity in a group of 67 dogs with
osteosarcoma: a pilot study
Article added / Artikel hinzugefügt 01.10.2021
Generally Articles and Discussions about Osteosarcoma in Dogs
→ Canine Periosteal Osteosarcoma
Images added / Abbildungen hinzugefügt 02.05.2019
Generally Sonography Atlas of Dogs →
Cardiovascular system → Pulmonary vessels
New subcategory added / Neue Unterkategorie hinzugefügt 02.05.2019
Generally Sonography Atlas of Dogs →
Cardiovascular system → Pulmonary vessels
Images added / Abbildungen hinzugefügt 01.05.2019
Generally Sonography Atlas of Dogs →
Cardiovascular system → Heart valvular diseases



Zum Osteosarkom - Eine vergleichende Literaturstudie

Stephan Dieckmann "Zum Osteosarkom - Eine vergleichende Literaturstudie"
Aus der Chirurgischen und Gynäkologischen Tierklinik der Tierärztlichen Fakultät der Ludwig-Maximilians-Universität München
Vorstand: Univ. Prof. Dr. Dr. habil. U. Matis
Arbeit angefertigt unter der Leitung von
Univ. Prof. Dr. Dr. habil. R. Köstlin

I. EINLEITUNG
Das Osteosarkom (OS) tritt als maligner Knochentumor des Hundes mit einer Häufigkeit von etwa 5 % auf. Bei 80% der Knochentumoren des Hundes kann ein Osteosarkom nachgewiesen werden. In 75% der Fälle ist das Osteosarkom an den Gliedmaßen lokalisiert (HAMMER et al. 1995). Es handelt sich hierbei um eine Tumorart mit außergewöhnlich aggressiver Potenz.
Für die Humanmedizin
stellt das Osteosarkom des Hundes ein wichtiges Modell zur Erprobung von Therapiemaßnahmen für den Menschen dar, da das Osteosarkom bei beiden Arten ein
nahezu identisches biologisches Verhalten aufweist, vor allem hinsichtlich des Ansprechens auf verschiedene Therapieansätze und damit auch hinsichtlich der zu
erwartenden Prognose. Daher ist es naheliegend bei diesem Thema interdisziplinär vorzugehen.
Zweck und Ziel der vorliegenden Arbeit war es, anhand der Literatur aufzuzeichnen, welche Therapieformen bzw. welche Faktoren sowohl
in der Human- wie in der Tiermedizin die Überlebenszeit von Patienten mit Osteosarkomen beeinflussen und welche Behandlungserfolge zum derzeitigen Zeitpunkt erzielt werden können. Dabei stellt
sich auch die Frage, welche Zusammenhänge zwischen den einzelnen Parametern bestehen und wie sie die Prognose beeinflussen.
II. LITERATURÜBERSICHT
1. DEFINITION, VORKOMMEN, LOKALISATION UND PRÄDISPOSITION
1.1. DEFINITION DES TUMORS
Die WHO-Klassifikation untergliedert das Osteosarkom in periostale und parostale Formen, die histopathologisch als schlecht differenzierte, nicht-produktive bzw. produktive osteoblastische, chondroblastische, fibroblastische, teleangiektatische, kombinierte und sogenannte Riesenzelltypen („giant cells type“) differenziert werden (WHO; MOULTON 1990).
Die Bildung von Osteoid ist charakteristisch. Die Tumoren wachsen sehr schnell, zeigen Knochendestruktion (osteoklastisch, osteolytisch) oder auch eine Vermehrung der Knochensubstanz (osteoblastisch).
Das primäre Osteosarkom
zeigt beim Hund, mit Ausnahme des Unterkiefers, durchgehend eine äußerst aggressive Potenz. Eine Metastasierung ist typisch und erfolgt bevorzugt in die
Lunge, aber auch in das Knochen- und Weichteilgewebe.
1.2. ÄTIOLOGIE
Die Ätiologie der meisten primären Knochentumoren ist unklar. Verschiedene Ursachen spielen möglicherweise eine Rolle. Als auslösende Faktoren werden chemische und physikalische Einflüsse durch Umweltfaktoren immunologische und genetische Faktoren angenommen.
In der Humanmedizin wird vereinzelt über die Entwicklung von Sarkomen im Narbengewebe infolge chirurgischer Eingriffe aufgrund eines
Traumas oder infolge von Hitze- bzw. Säureverbrennungen berichtet. Ebenso an Frakturstellen insbesondere in der Nähe von Plastik-, Metall- oder verschiedenen Biomaterialimplantaten. Diese Sarkome
entstehen dabei gewöhnlich nach einer Latenzzeit von mehreren Jahren (ABOULAFIA et al. 1999; OZYAZGHAN und KONTAS 1999; KIRKPATRICK et al. 2000).
Die Entwicklung eines Tumors erfolgt auf der Basis dynamischer Alterationen im Genom gesunder Zellen, deren Auswirkungen zu
Veränderungen in der Zellphysiologie (Tabelle 1) führen (HANAHAN UND WEINBERG 2000).

1.3. PRÄDISPOSITION, LOKALISATION, ALTER, GRÖßE, RASSE UND GESCHLECHT
Es sind vor allem Hunde mittleren Alters und ältere Hunde, die am Osteosarkom erkranken. An Tumoren des Anhangskeletts erkranken die Hunde klinisch durchschnittlich im Alter von 7 (MOULTON 1990) – 7,5 Jahren (WHITE 1998). Es wird jedoch auch ein sehr frühzeitiges Auftreten beschrieben, zum Beispiel bei einem 6 Monate alten Welpen (PHILLIPS et al. 1986) und eine Häufung der Fälle im Alter zwischen 18 – 24 Monaten (MISDORP und HART 1979). Verglichen mit Tumoren des Anhangskeletts treten Primärtumoren der Rippen tendenziell im jüngeren Alter zwischen 4,5 – 5,4 Jahren auf (HEYMAN et al. 1992; FEENEY et al. 1982), während Tumoren der Schädelknochen vermehrt im höheren Alter auftreten (HARDY et al. 1967). Als durchschnittliches Alter für das Auftreten an der Wirbelsäule wird ein Alter von 7 Jahren beschrieben (MORGAN et al. 1980). Von der Erkrankung sind vor allem große und langbeinige Hunde betroffen. Mittlere (20 – 40kg) und große Hunde (über 40kg) erkranken 7,9-mal häufiger am Osteosarkom als kleine Hunde, die weniger als 20kg wiegen (TJALMA 1966).
Das Gewicht und vor allem die Höhe des Hundes stehen in einem wichtigen Zusammenhang mit dem Auftreten und der Lokalisation der Erkrankung.
Während schwere Tiere vorwiegend an Tumoren des Bewegungsapparates erkranken, weisen leichtere Tiere zum größten Teil Erkrankungen im Bereich des Stammes auf.
Zu diesem Ergebnis kam man in einer retrospektiven Studie mit 1462 Tieren (KISTLER 1981). In 29% der Fälle waren Hunde mit einem Gewicht von über 40kg betroffen, nur 5% dieser Tiere wiesen Tumoren am Stamm auf. Hunde mit einem Gewicht unter 15kg waren nur zu 5% betroffen, sie hatten jedoch in 59% der Fälle Tumoren am Stamm entwickelt.
Beim Hund kommen 85% aller Osteosarkome bei den Groß- und Riesenrassen vor (WHITE 1998). Zu den Risikorassen scheinen der Bernhardiner, Deutsche Doggen, Irish Setter, Dobermänner, Deutsche Schäferhunde und Golden Retriever zu gehören (DERNELL et al. 2001). Eine weitere amerikanische Studie ergänzt die Liste um den Boxer und den Great Dane (BRODEY und RISER 1969), eine niederländische Studie fügt den Rottweiler dazu (MISDORP und HART 1979). Eine jüngere retrospektive Studie wertete die Daten von 179 Fällen des appendikulären Osteosarkoms beim Hund in den Jahren 1996 – 2005 aus (ROSENBERGER et al. 2007). Demnach erkranken bestimmte Rassehunde deutlich häufiger als Mischlingshunde. Vor allem Greyhounds (6,2%), Rottweiler (5,3%) und Great Danes (4,4%) sind betroffen. Das Geschlecht konnte bei diesen Rassen nicht als Risikofaktor eingestuft werden, jedoch scheinen alle drei Rassen mit zunehmendem Alter einem erhöhten Risiko ausgesetzt zu sein. Greyhounds erkrankten durchschnittlich im Alter von 9,9 Jahren, Rottweiler im Alter von 8,3 und Great Danes im Alter von 7,8 Jahren.
Mehreren Studien zufolge scheinen Rüden häufiger von der Erkrankung betroffen zu sein als Hündinnen (BRODEY und RISER 1 969; JACOBSON 1958; LING et al. 1974; MISDORP und HART 1979).
1.4. LOKALISATION DES TUMORS
82% der Tumore sind an den Gliedmaßen lokalisiert. In abnehmender Reihenfolge vor allem an den folgenden Lokalisationen: Distaler Radius, proximaler Humerus, proximal sowie distales Femur und Tibia.
Beim Rottweiler und Great Dane scheinen vor allem die Vordergliedmaßen betroffen zu sein (ROSENBERGER et al. 2007).
Mit abnehmender Größe der Hunde steigt die Häufigkeit für Tumoren am Stammskelett.
Der Boxer neigt zu Tumoren an den Schädelknochen (WHITE 1998).

1.5. OSTEOSARKOM BEI ANDEREN ARTEN
Die Katze entwickelt im Vergleich zum Hund wesentlich seltener Osteosarkome. Sie entwickelt generell weniger primäre Knochentumoren (DORN et al. 1968). Die Inzidenz wird für den Hund mit 6,5 auf 100000 Neoplasiefälle und bei der Katze mit 3,5 auf 100000 Neoplasiefälle beschrieben (SCHNEIDER 1966). Unter den malignen Knochentumoren tritt das Osteosarkom beim Hund in 80% (BRODEY und RISER 1969) und bei der Katze in 70% der Fälle auf (TURREL und Pool 1982).
Katzen erkranken durchschnittlich im Alter von 10 Jahren und damit etwa 3 Jahre älter als Hunde. Bevorzugt sind ältere Kater betroffen, bei denen die Osteosarkome vor allem an den Metaphysen der langen Röhrenknochen beobachtet werden (BRODEY und RISER 1969; JACOBSON 1971; TURREL und POOL 1982). Die häufigsten Lokalisationen sind das distale Femur, die proximale Tibia und der proximale Humerus. Die klinischen Symptome sind von der Lokalisation abhängig und ähneln denen des Hundes (WHITE 1998).
Die Methode der Wahl bei Gliedmaßentumoren der Katze ist die Amputation. Die Prognose ist bei der Katze wesentlich günstiger
zu stellen als beim Hund, da sie eine Amputation meist außerordentlich gut kompensiert, eine geringe Neigung zur Metastasierung hat und in aller Regel auf eine Chemotherapie verzichtet werden
kann (TURREL und POOL 1982).
6 von 12 Katzen, die lediglich einer Amputation unterzogen wurden, waren nach 64 Monaten noch am Leben. Die verendeten Tiere erreichten eine durchschnittliche Überlebenszeit von 49,2 Monaten (BITETTO et al. 1987).
Einer jüngeren Studie zufolge erreichten Katzen, die lediglich einer Amputation unterzogen wurden, eine durchschnittliche Überlebenszeit von 2 Jahren (MCENTEE et al. 1991).
Die Prognose für das Osteosarkom des Rumpfskelettes ist bei der Katze jedoch deutlich ungünstiger, die durchschnittliche Überlebenszeit nach einer lokalen Exzision beträgt nur 5,5 Monate (BITETTO et al. 1987).
Nach einer unzureichenden Exzision erfolgt eine Rezidivierung innerhalb kürzester Zeit. Die daraus resultierende Anwendung einer Chemo- und Strahlentherapie ist bei der Katze nicht hinreichend beschrieben. Für Katzen besteht jedoch eine speziesspezifische, dosisabhängige primäre Lungentoxizität für Cisplatin (KNAPP et al. 1987).
Nach JACOBSON (1971) scheint die Bedeutung des Osteosarkoms bei anderen Tierarten von geringem Grad und Interesse zu sein, daher gibt es nach dessen Kenntnisstand keine sinnvoll vergleichbaren Daten zu anderen Tierarten.
2. DIAGNOSE UND DIFFERENTIALDIAGNOSTISCHE ABGRENZUNG
Bezüglich der Diagnosestellung stellen sich zwei grundsätzliche Fragen: Zunächst muss abgeklärt werden, ob es sich bei der
vorgestellten Erkrankung um eine neoplastische Entartung handelt und wenn ja, um welche Art von Neoplasie. Der Verdacht auf eine Neoplasie wird zunächst durch bildgebende Verfahren, insbesondere
durch die Röntgenuntersuchung der betroffenen Stelle bestätigt. Röntgenbilder lassen jedoch nicht immer eine Unterscheidung zwischen dem Osteosarkom und anderen primären Knochentumoren zu (BERG
1996). Eine eingehende differentialdiagnostische Abklärung erfolgt anhand der Anamnese und durch den Einsatz von Biopsietechniken mit entsprechender Labordiagnostik. Ein Tumorausschluss ist mit
hinreichender Wahrscheinlichkeit möglich, wenn nach klinischer, bildgebender und labordiagnostische Untersuchung keine Raumforderung nachweisbar ist. Ebenso, wenn sich die Schwellung bzw. die
nachgewiesene Raumforderung oder die bestehenden unklaren Beschwerden durch eine nichttumoröse Erkrankung erklären lassen.
2.1. DIFFERENTIALDIAGNOSTISCHE MÖGLICHKEITEN

2.2. ANAMNESE, KLINISCHES BILD
Die Tiere werden für gewöhnlich mit schmerzhaften Schwellungen und Umfangsvermehrungen in Anlehnung an das Knochengewebe
präsentiert. Tiere, bei denen die Gliedmaßen betroffen sind, werden mit einer chronischen Lahmheit vorgestellt (DERNELL et al. 2001).

Ist der Schädel betroffen, hängt die Symptomatik von den unmittelbaren Folgen für das umliegende Gewebe ab. Es können Exophthalmus, Kau- und Schluckbeschwerden, Nasenausfluss, Deformationen oder zentralnervöse Ausfälle beobachtet werden.
Tumoren der Rippen treten ebenfalls als Schwellungen auf. Wird die Pleura in Mitleidenschaft gezogen, kann es im Zuge des Krankheitsverlaufs zu Ergüssen kommen, die zur Dyspnoe führen. Große Teile des Tumors können dann auch intrathorakal liegen (FEENEY et al. 1982; WHITE 1998).
Die nähere Konsultation des Besitzers erbringt oftmals den Hinweis, dass in den letzten Monaten eine Traumatisierung der betroffenen
Stelle stattgefunden hat. In der Regel kann eine harte schmerzhafte Knochenauftreibung bzw. Schwellung am Knochen adspektorisch und palpatorisch wahrgenommen werden.
An den Gliedmaßen ist meist der Metaphysenbereich betroffen (DERNELL et al. 2001). Extrem große Tumoren führen im Rahmen eines
neoplastischen Syndroms zu gewichtsunabhängiger Lahmheit, starker Muskelatrophie und Krebskachexie.

2.3. RADIOLOGISCHE ABKLÄRUNG
Es zeigen sich Auflösungserscheinungen des Cortex und/oder des Marks und eine Neubildung von Knochensubstanz im Tumor und/oder unter dem Periost, Einwachsen von Knochengewebe in angrenzendes Weichteilgewebe, eine Weichteilschwellung und eine punktförmige Knochenlysis (LING et al. 1974; FEENEY et al. 1982; GIBBS et al. 1984; LARUE et al. 1986).
Damit besteht ein erster Verdacht auf eine Neoplasie, genauer gesagt auf einen primären Knochentumor. Ähnliche Veränderungen am Knochen wie sie bei primären Knochentumoren der Fall sind, treten auch bei einer infektiösen Osteomyelitis auf (OXENFORD und MIDDLETON 1986). Eine entsprechende differentialdiagnostische Abgrenzung hierfür erfolgt vor allem durch die Anamnese. Eine bakterielle Osteomyelitis tritt bei Hunden in der Regel als Komplikation nach penetrierenden Verletzungen, einem lokalen chirurgischen Eingriff, einer Frakturbehandlung mit metallischen Implantaten oder infolge eines Drainagegebrauchs auf. Eine pilzinduzierte Osteomyelitis tritt endemisch in bestimmten Gebieten oder nach Reisen auf.
Unter Berücksichtigung der gewonnenen Fakten aus der Anamnese ist es jedoch vor allem der Auflösungsprozess im Cortex, der ausschlaggebend für die Annahme ist, dass es sich um eine Neoplasie des Knochens, einen primären Knochentumor, handelt. Erhärtet sich der Verdacht auf eine neoplastische Erkrankung, muss die Diagnose gegenüber anderen primären Knochentumoren abgegrenzt werden. Dazu gehören das Fibrosarkom, Chondrosarkom, Hämangiosarkom, das Lymphom und Myelom. Ebenso müssen Metastasen von Primärtumoren anderen Ursprungs, die bereits behandelt wurden oder noch zu suchen sind, für die Differentialdiagnose in Betracht gezogen werden (WITHROW 1998). Zusätzlich müssen immer Röntgenaufnahmen des Brustkorbs angefertigt werden, um eine sichtbare Metastasierung in die Lunge abzuklären. Dazu sind drei Aufnahmen notwendig, eine rechts- und linksanliegende laterale und eine dorsoventrale Aufnahme (LANG et al. 1986).
Über 98% der Tiere haben zum Zeitpunkt der klinischen Manifestation des Primärtumors bereits Metastasen entwickelt, aber nur in
weniger als 10% der Fälle sind diese groß genug, so dass man sie sehen kann (WITHROW 1998). Sind sie bereits sichtbar, ist die Prognose als extrem ungünstig zu stellen. Eine Chemotherapie wird
keine deutliche Verbesserung der Überlebensrate erzielen (OGILVIE et al. 1993). Radiografische Verfahren (LARUE et al. 1986) und die Knochenszintigraphie (BERG et al. 1990) wurden als
Möglichkeiten herangezogen, um okkulten Knochenmetastasen auf die Spur zu kommen. Es konnten damit jedoch keine nennenswerten Ergebnisse erzielt werden.
Beurteilung von Tumoren und tumorähnlichen Veränderungen im Röntgenbild
Das Ausmaß der Erkrankung muss klar erfasst werden, um Tumore oder tumorähnliche Veränderungen gezielt behandeln zu können.
Zunächst gilt es, die Lage und Größe der Läsion am Knochen zu beschreiben (LING et al. 1974).

Danach wird die Qualität der Läsion erörtert. Die Indizien können für ein gutartiges oder aggressives Verhalten sprechen. Hierbei sind die Wachstumsgeschwindigkeit, das biologische Wachstumsverhalten, die Beteiligung der umliegenden Gewebe und die Tumormatrix von Bedeutung. Eine Aussage über die Wachstumsgeschwindigkeit wird durch die Beurteilung der Randbegrenzung der Läsion und durch deren Destruktionstyp getroffen (GIBBS et al. 1984).
Ein schmaler Läsionsrand, auch als Sklerosezone (reaktive Knochenneubildung) bezeichnet, spricht für eine langsam
wachsende Veränderung, während ein infiltrierendes Wachstum mit einem unscharfen, verwaschenen Rand und einer breiten Übergangszone für eine aggressiv wachsende Veränderung spricht. Die Reaktion
des Tumorgewebes mit dem Periost lässt mehrere Schlüsse zu: Langsam wachsende Veränderungen lassen ein unversehrtes, allenfalls verdicktes Periost zu, während aggressiv wachsende Veränderungen
das Periost unterbrechen. Es kommt zu einem spikulären oder lamellären Durchbruch von Tumorgewebe oder zu einer Ausbildung eines Codeman-Dreiecks. Das Codman-Dreieck entsteht durch die Bildung
von reaktivem Knochen zwischen Kortikalis und Periost. Ist bereits das Weichteilgewebe involviert, spricht das für ein aggressives Verhalten. Das Röntgenbild gibt uns außerdem Informationen über
die Gewebezusammensetzung des Tumors. Osteoblastische Knochenbildungen stellen sich als wolkige, watteartige Veränderungen dar, chondroblastische Knochenbildungen als ringförmige, popcornund
girlandenartige oder kommaförmige Verkalkungen. Fibroblastische Veränderungen sind fast vollständig strahlentransparent.


2.4. HISTOLOGIE UND KLASSIFIKATION
Besteht nach Abschluss der noninvasiven Diagnostik weiterhin ein Tumorverdacht oder eine Unklarheit über die Art und Dignität eines Tumors, ist die histopathologische Untersuchung einer Gewebeprobe angezeigt. Führen Anamnese, klinische Untersuchung und Röntgenbefunde zu der Annahme, dass es sich bei dem Krankheitsgeschehen um einen primären Knochentumor handelt, ist eine Amputation anzuraten oder ein ein gliedmaßenerhaltender Eingriff (Limb-Sparing) ohne vorherige Biopsie durchzuführen.
Bestehen jedoch Zweifel am Verdacht auf einen primären Knochentumor oder wünscht der Besitzer eine vollständige Abklärung des Verdachtes, wird eine Biopsie vor der Behandlung durchgeführt, um die gewonnene Probe histologisch bewerten zu können.
Auf jeden Fall sollte der entfernte Tumor postoperativ einer histologischen Untersuchung unterzogen werden, um die erfolgreiche Exzision im Hinblick auf die zu erwartende Prognose bestätigen zu können oder um die vorangegangene Diagnose im Nachhinein festigen zu können.
Histologisch ist Spindelzellstroma sichtbar, das Osteoid und gelegentlich unreifen Knochen bildet. Ebenso kann eine Knorpelbildung stattfinden.
Das Verhältnis zwischen Osteoid, Knochen und Knorpelsubstanz variiert.
So wird das klassische intramedulläre Osteosarkom je nach Bild und vorherrschenden Zellen in Osteoblasten-, Fibroblasten- und
Chondroblastentypen eingeteilt. Ein Typ mit Teleangiektasien weist große blutgefüllte Hohlräume auf, die mit Osteo-blasten ausgekleidet sind, jedoch kaum Osteoid bilden.
Grundregeln der Biopsietechnik (WITHROW UND LOWES 1981)
- Entnahme der Probe bei Tumoren im Extremitätenbereich soweit distal wie möglich.
- Wahl des Zuganges in der Schnittführung der wahrscheinlich durchzuführenden Operation.
- Der direkte Zugang zum Tumor (kürzester Weg) ist zu bevorzugen, wobei die später notwendige vollständige Entfernung des Biopsiekanals zusammen mit dem Tumorresektat berücksichtigt werden muss.
- Keine Ausdehnung auf subtotale Tumorexstirpation.
- Keine Eröffnung zusätzlicher Kompartmente oder Gelenke.
- Keine Kontamination von Gefäß-Nerven-Strängen.
- Drainageausleitung aus der Wunde oder in unmittelbarer Nähe des Wundwinkels.
- Atraumatische Operationstechnik (z.B. Intrakutannaht) und subtile Blutstillung.
- Entnahme einer ausreichenden Gewebsmenge (mindestens 1 cm3).
- Meidung einer Quetschung oder sonstigen Zerstörung des Gewebsverbandes.
- Die entnommene Gewebeprobe muss repräsentativ sein und vitales Gewebe aus der Tumorrandzone enthalten. Im Zweifelsfall muss eine
Schnellschnittuntersuchung zur Prüfung erfolgen, ob das Biopsiematerial vitale Tumoranteile enthält.
2.4.1.1. INZISIONSBIOPSIE
Die besten Ergebnisse werden erzielt, wenn ein Knochentrepan eingesetzt wird, mit dem man eine Probe von der gesamten Knochendicke erhält. Als geeignete Instrumente werden hierfür vor allem eine Harlow-Woods-Spinalbiopsienadel, ein Michele-Trepan oder eine Jamshidi-Knochenmarknadel beschrieben (WYKES et al. 1985; POWERS et al. 1988).
Eine Nadelbiopsie sollte nach Möglichkeit unter sterilen Bedingungen erfolgen (WHITE 1998): Nach der Sedierung des Patienten werden
die Haare geschoren und die Haut desinfiziert. Mit dem Skalpell wird ein kleiner Einschnitt angelegt, um mit der Biopsienadel möglichst schonend in den Tumor zu gelangen. Bei der Auswahl der
Trepanationsstelle ist zu berücksichtigen, dass sie beim nachfolgenden chirurgischen Eingriff mit entfernt werden kann. Die Lage des Trepans kann während des Eingriffes röntgenologisch
kontrolliert werden. Falls möglich werden mehrere Entnahmen vorgenommen, um ein repräsentatives Bild zu erhalten. Es sollten Proben aus der Mitte der Neubildung und der Randzone entnommen werden.
Gerade Randzonenproben lassen eine gute Unterscheidung zwischen gesunden und neoplastischen Zellen zu. Ist eine Frakturierung des Knochens zu erwarten, werden nur Proben aus der Kortikalis und
der Markhöhle gewonnen.
Mit zunehmender Anzahl an Proben erhöht sich die Genauigkeit einer Tumorentdeckung auf 92–94% (POWERS et al. 1988).
Die gewonnenen Bioptate werden sofort aus der Nadel entnommen und unverzüglich in Formalin gegeben. Auftretende Blutungen werden durch Druck oder Knochenwachs gestillt und die Wunde verschlossen.
2.4.1.2. ZYTOLOGISCHE BIOPSIEENTNAHME
Die Zytologie sollte nicht als Ersatz für eine histopathologische Untersuchung angesehen werden. Sie dient hauptsächlich zur Unterscheidung zwischen tumorösen und nichttumorösen Veränderungen (WITHROW 1991; MEYER UND HARVEY 1998).
Sarkomarten, die überwiegend aus fibrösem Stroma bestehen, erbringen in der Exfoliationszytologie wenig Information (MEYER UND
HARVEY 1998).
Der wichtigste Vorteil der Zytologie ist die Schnelligkeit, die einfache Durchführbarkeit und die geringe Belastung für den
Patienten. Das Untersuchungsmaterial wird durch eine Feinnadelpunktion gewonnen. Die Fixierung des zytologischen Präparats erfolgt durch Lufttrocknung oder durch eine Behandlung mit
Alkohollösungen. Die Färbung erfolgt nach Giemsa oder Pappenheim (MEYER 1987; WITHROW 1991).

2.4.2. KLASSIFIKATION
Tumore müssen identifiziert und die onkologische Qualität festgestellt werden, um diese im Anschluss entsprechend einschätzen und behandeln zu können. Die Basis hierfür liefert die Histologie bzw. die Histogenetik (MEYER UND HARVEY 1998; LOUKOPOULOS und ROBINSON 2007).
Die Identifikation von Tumoren erfolgt auf der Basis des histologischen Zelltyps. Werden verschiedene Differenzierungstypen nachgewiesen, so bestimmt das am weitesten entwickelte Stadium den Tumor (SCHAJOWICZ at al. 1995). Ein Tumor mit osteoblastischen Veränderungen und Osteoidbildung ist folglich ein Osteosarkom, auch dann, wenn fibroblastische und chondroblastische Zellen nachgewiesen werden können.
Die onkologische Qualität eines Tumors wird durch seine typischen Eigenschaften und vor allem durch sein biologisches Verhalten bestimmt.
Um den Zusammenhang zwischen Zelltyp und onkologischer Qualität entsprechend darstellen zu können, wurde für Knochentumore die
nachfolgende Tabelle mit den Ergebnissen von SCHAJOWICZ at al. (1995) in Anlehnung an die WHOKlassifikation (OWEN 1980; FLETCHER 2006) erstellt.


Gradingsystem und Stadieneinteilung Tumoren müssen aufgrund ihres unterschiedlichen biologischen Verhaltens und der sich damit verändernden Prognose nach ihrer onkologischen Qualität systematisiert werden. Mit FLETCHER wurde 2002 das TNM-System eingeführt. Mit T wird die Größe des Tumors bezeichnet (T0-T3), mit N das Vorliegen regionaler Lymphknotenmetastasen (N0-N1) und mit M das Vorhandensein von Metastasen (M0-M1). Sarkome neigen selten zu einer regionalen Lymphknotenmetastasierung, daher wird bei diesen Tumoren das TNM-System normalerweise nicht angewendet. Von ENNEKING wurde in den Jahren 1980–1986 das „Musculoskeletal Tumour Society Staging-System“ eingeführt, das mittlerweile überwiegend verwendet wird. Das System beruht auf drei Parametern:
Gradingsystem (GTM):
G – bezeichnet den Malignitätsgrad des Tumors
T – die anatomische Ausdehnung des Tumors
M – den Grad der Metastasierung
Der Tumorgrad (G) wird auf histogenetischer Grundlage generell in niedrig- und hochmaligne Tumoren unterteilt, wobei der Tumorgrad durch den Mitoseindex, das Ausmaß der Nekrose und die Anzahl pleomorpher Zellkerne gekennzeichnet wird. ENNEKING (1980) klassifiziert zwischen G0, G1 und G2. Der Tumorgrad G0 beschreibt einen gutartigen Tumor, der gut differenziert ist und eine deutliche Kapsel ohne Tumorsatelliten, Skip-Läsionen (Tumoranteile, die im Kompartment liegen, aber zum Tumor keine direkte Verbindung haben) oder Metastasen zeigt. Der Tumorgrad G1 beschreibt einen geringgradig bösartigen Tumor, der sich meist schmerzlos und überwiegend langsam vergrößert, eine moderate Zelldedifferenzierung und extrakapsuläre Satelliten aufweisen kann. Der Tumorgrad G2 klassifiziert einen hochgradig bösartigen Tumor mit schlechter Differenzierung, Zellaplasien und einem schnellen Wachstum. Diese Tumoren neigen zu einer frühen regionalen und systemischen Metastasierung. Die anatomische Lokalisation zum Kompartment (T) bezeichnet die lokale Aggressivität. Die Aggressivität eines Tumors wird durch seine Lage und vor allem durch seine Beziehung zu seiner Pseudokapsel und dem umliegenden Gewebe definiert. Nach dem Staging-System von ENNEKING (1986) wird intrakapsuläres Wachstum mit T0, intrakompartmentelles Wachstum mit T1 und extrakompartmentelles Wachstum mit T2 bezeichnet. Perforiert ein Tumor z. B. die Kortikalis, so wird er als extrakompartmentell definiert. Hinsichtlich der Metastasierung unterscheidet ENNEKING das Tumorstadium M0, bei dem noch keine Metastasierung stattgefunden hat und das Tumorstadium M1, bei dem eine Metastasierung bereits erfolgt ist.
Das histologische Grading beschreibt somit das biologische Verhalten des Tumors. Auf dieser Basis nimmt ENNEKING eine
Stadieneinteilung in gut- und bösartige Knochentumoren vor, an der sich der onkologische Chirurg orientieren kann. Stadium I beschreibt niedrigmaligne Tumoren ohne Metastasierung, Stadium II und
III beschreiben hochmaligne Tumoren, wobei Stadium II noch keine Metastasen entwickelt hat, Stadium III jedoch schon. Die Buchstaben A und B weisen auf ein intra- und extrakompartmentelles
Wachstum hin.

Osteoblastische Osteosarkome weisen höhere Grade als fibroblastische Osteosarkome auf. Junge Hunde in einem Alter unter 4
Jahren entwickeln Tumoren höheren Grades als Ältere. Gliedmaßentumore und distal sitzende Tumore weisen einen höheren Grad auf als Stammtumore und proximal gelegene Tumore. Tumoren des Schädels
weisen eine niedrige Mitoserate auf, Rippentumoren hingegen eine sehr hohe Mitose- und Nekroserate (LOUKOPOULOS und ROBINSON 2007). Die Mitoserate der Biopsie ist der entscheidende Faktor. Eine
bewertende Studie über den Krankheitsverlauf von 303 Hunden kommt zu dem folgenden Ergebnis: Je höher der histologische Grad einzustufen ist, desto schlechter ist die Prognose hinsichtlich der
Überlebenszeit zu stellen (MOORE et al. 2007).

2.5. LABORDIAGNOSTISCHE PARAMETER, HÄMATOLOGIE UND HARNWERTE
2.5.1. ALKALISCHE PHOSPHATASE
Sowohl beim Menschen (GRUNDMANN et al. 1983) als auch beim Hund (BAUMGÄRTNER et al. 1996) werden erhöhte Werte der alkalischen Phosphatase nachgewiesen, die bereits bei der metaphysealen Osteosklerose junger Hunde auftreten.
Die Aktivität der alkalischen Phosphatase, SAP (TALP: total serum alkaline phosphatase), BAP (BALP: bone alkaline phosphatase) und LAP (LALP: liver alkaline phosphatase), sind wichtige Parameter für die Prognosestellung bei der Behandlung des Osteosarkoms der Gliedmaßen.
Physiologische Werte der SAP liegen bei etwa 130 U/L (KRAFT et al. 1973, 1983). Die BALP-Aktivität beträgt im Serum von erwachsenen Hunden verschiedenen Alters 2127 ± 11,4 U/L. Sie nimmt im Alter zu (SANECKI et al. 1993).
Hunde mit einer normalen SAP-Aktivität vor der Behandlung überleben deutlich länger als Hunde mit erhöhten Werten (GARZOTTO et al. 2000). In einer Studie mit 61 Hunden erzielten Tiere mit einem TALP–Wert im Normbereich eine mittlere Überlebenszeit von 12,5 Monaten, aber Tiere mit einer erhöhten TALP–Aktivität eine mittlere Überlebenszeit von nur 5,5 Monaten. Tiere mit einem BALP–Wert im Normbereich wiesen eine mittlere Überlebenszeit von 16,6 Monaten auf, solche mit einer erhöhten BALP–Aktivität jedoch nur eine mittlere Überlebenszeit von 9,5 Monaten.
Die Bewertung des Krankheitsverlaufs von 303 Hunden mit einem Osteosarkom führte zu dem Ergebnis, dass anfangs erhöhte SAP- und BALP-Werte nach einer Behandlung in einer deutlich kürzeren Überlebens- und Rezidivzeit resultieren (MOORE et al. 2007). Sprechen erhöhte Werte vor der Behandlung für eine schlechtere Prognose, sollte versucht werden über eine entsprechend verstärkte adjuvante Therapie den Behandlungserfolg zu steigern (EHRHART et al. 1998). Konsekutiv muss bei der folgenden Chemotherapie und/ oder Radiotherapie der Einsatz von höheren und aggressiveren Dosen erfolgen.
Tritt nach der Behandlung kein signifikanter Abfall der Enzymaktivitäten ein, muss eine deutlich kürzere Überlebenszeit
und schnellere Rezidivzeit erwartet werden. Die weitere Prognose wird daher als „schlecht“ betrachtet.

Hunde mit normalen SAP- und BAP-Enzymwerten vor der Behandlung überlebten signifikant länger als Hunde, die vor der Behandlung erhöhte Aktivitätswerte der alkalischen Phosphatase aufwiesen (ERHARD et al. 1998).
2.5.2. KOHLENHYDRAT- UND PROTEINSTOFFWECHSELRATE
Ebenso wie bei Menschen, die an einer Neoplasie erkrankt sind, können auch bei Hunden, die vom Osteosarkom befallen sind,
Veränderungen des Energieverbrauchs, der Proteinsynthese, des Harn-Stickstoffverlustes und des Kohlenhydratstoffwechsels beobachtet werden (CHLEBOWSKI UND HERBER 1986; HERBER et al. 1986;
MCANDREW 1986; OGILVIE et al. 1996). Auch bei Tieren, die noch keine klinischen Anzeichen einer Kachexie aufweisen, kann ein deutlich erhöhter Energieverbrauch in der Ruhephase REE (resting
energy expenditure), eine verminderte Proteinsynthese, eine erhöhte Stickstoffausscheidung im Urin und ein erhöhter Glucosedurchfluss gemessen werden (MAZZAFERRO et al. 2001). Diese Veränderungen
wurden in einer entsprechenden Studie erfasst und dokumentiert.
3. PROGNOSE
Im Folgenden werden die Prognose zum Zeitpunkt der Diagnose und die Prognosestellung in Hinblick auf die verschiedenen Therapieansätze diskutiert. Ein wichtiger Bestandteil der Prognosestellung ist die Einschätzung des Zustandes und Stadiums des Krankheitsgeschehens zu einem bestimmten Zeitpunkt (LOUKOPOULOS und ROBINSON 2007).
Um im Weiteren eine fallangepasste Planung der therapeutischen Vorgehensweise durchführen zu können, ist es zunächst wesentlich,
sich über die Lokalisation, die Ausbreitung und den histologischen Typ zu informieren. Der histologische Typ ist bestimmend für die Aggressivität des Tumors und bestimmt damit das Auskommen.
Teleangiektatische Tumoren sowie Tumoren der Rippen und des Schulterblattes neigen am stärksten zur Metastasierung und einer kurzen Überlebenszeit von 12 Tagen. Von 48 Tieren wurden 21 aufgrund
lokaler Rezidive euthanasiert (HAMMER et al. 1995).
Beim Osteosarkom des Schulterblattes zeigte sich nach der Amputation und einer zusätzlichen Chemotherapie eine sehr schlechte Prognose beim Hund (HAMMER et al. 1995) und der Katze (TROUT et al. 1995).
Tiere mit einem Osteosarkom distal des Vorderfußwurzel- oder des Hinterfußwurzelgelenkes weisen eine etwas längere Überlebenszeit (im Mittel 466 Tage) auf als solche mit proximaler Lokalisation (GAMBLIN et al. 1995). Die Aggressivität und die Gefahr der Metastasierung sind gleich hoch einzuschätzen. Das biologische Verhalten des Osteosarkoms am Stamm stellt sich ähnlich aggressiv dar wie an den Gliedmaßen, jedoch mit Ausnahme der Lokalisation am Unterkiefer (DICKERSON et al. 1998). Hunde, die ausschließlich einer Amputation des Unterkiefers unterzogen wurden, wiesen in mehreren Studien in 71% der Fälle eine Überlebensrate von einem Jahr auf (KOSOVSKY et al. 1991; SCHWARZ et al. 1991; WHITE 1991; STRAW et al. 1996).
Anders liegt der Fall, wenn der Oberkiefer betroffen ist. Hier erreichten die Hunde nur eine mittlere Überlebensrate von 5 Monaten (SCHWARZ et al. 1991; WALLACE et al. 1992). Ähnlich verhält es sich auch mit der Erkrankung anderer Schädelknochen, wobei die Tendenz einer Metastasierung eines Osteosarkoms des Schädels in die Lunge im Allgemeinen deutlich geringer sein soll (HARDY et al. 1967). Die mittlere Überlebenszeit der Tiere mit einem Osteosarkom an den Rippen beträgt 3 Monate, wenn die Patienten nur einer Amputation unterzogen wurden und 8 Monate, wenn eine Amputation und gleichzeitig eine Chemotherapie durchgeführt wurden (MATTHIESEN et al. 1992; PIRKEY-EHRHART et al. 1995).
Das Osteosarkom der flachen Knochen zeigt beim Menschen ein ähnlich aggressives biologisches Verhalten wie in den langen Röhrenknochen (REMAGEN et al. 1983; DUFFAUD et al. 2000).
Bei Tieren ist die Wirbelsäule selten betroffen, die beschriebenen Fälle zeigen jedoch sowohl lokal als auch systemisch eine hohe aggressive Potenz und ein aggressives Verhalten (MORGAN et al. 1980; HEYMAN et al. 1992). In einem Bericht wurden 20 Tiere einer Behandlung mit Amputation, Chemo- und Strahlentherapie unterzogen, wobei die mittlere Überlebenszeit 4 Monate betrug (DERNELL et al. 2000). Therapieansätze in anderen Bereichen des Stammes wurden bis dato unzureichend beschrieben. Für den Verlauf des Krankheitsgeschehens und der Therapie kleiner Hunde gibt es nur wenige Informationen (COOLEY und WATERS 1997).
In den Weichgeweben liegende Osteosarkome besitzen ebenfalls ein systemisch aggressives Verhalten. In einer Untersuchung erzielten diejenigen Patienten, die nur einer Amputation unterzogen wurden, eine mittlere Überlebenszeit von einem Monat, während andere Patienten, die zusätzlich eine Chemotherapie erhielten, eine mittlere Überlebenszeit von 5 Monaten erreichten (KUNTZ et al. 1998).
In einer anderen Studie wurden Behandlungen und Erfolge von Osteosarkomen der Mammaleiste mit Osteosarkomen anderer Weichteilgewebe
verglichen. Zur Behandlung wurden die Bereiche lediglich reseziert, weitere Behandlungsformen wurden nicht angewandt. Die mittlere Überlebenszeit der ersten Gruppe (Mamma) betrug 3 Monate, die
der zweiten Gruppe einen Monat (LANGENBACH et al. 1998). Eine Prognose hinsichtlich des Therapieerfolges bei der Behandlung des Osteosarkoms kann nur sehr vage gestellt werden. Generell handelt
es sich hierbei um eine äußerst aggressive Erkrankung. Lediglich Osteosarkome des Kopfes, insbesondere der Mandibula, haben eine recht günstige Prognose bei einer rechtzeitigen Resektion. Im
Übrigen ist die Prognose aufgrund der frühzeitigen Metastasierung verhalten bis ungünstig.
Erfolgt keine Therapie, leiden die Tiere infolge der starken Destruktion von Knochen und Weichteilgewebe an massiven Schmerzen.
Unterbleibt eine Behandlung, entscheiden sich daher die Besitzer alsbald für die Euthanasie (DERNELL et al. 2001). Um die Entscheidung zu erleichtern, ob überhaupt eine Behandlung erfolgen soll
und wenn ja, welche und unter welchen Aussichten, müssen jedoch die in Tabelle 11 dargelegten Gesichtspunkte in Betracht gezogen werden.

Welche Vorgehenstaktik in Betracht gezogen wird, hängt im Wesentlichen von diesen prognostischen Faktoren ab. Eine entscheidende Rolle scheint die Tatsache zu spielen, ob sich bereits zum Zeitpunkt der Diagnose manifeste Metastasen gebildet haben. Dieser Umstand ist hinsichtlich der zu erwartenden Prognose von herausragender Bedeutung (CAMPANACCI et al. 1981; GIULIANO et al. 1984; BACCI et al. 1987; O’BRIEN et al. 1993; OGILVIE et al. 1993; DOWNEY 1999; DERNELL 2001).
Der chirurgische Eingriff zur Behandlung des Primärtumors, bei dem aufgrund der hohen lokalen Rezidivrate ein absoluter Sicherheitsabstand eingehalten werden muss, bleibt in Abhängigkeit von der Lokalisation des Tumors in jedem Fall das Mittel der Wahl (BRODERY et al. 1969; MADEWELL et al. 1978; SHAPIRO et al. 1988; SPODNICK et al. 1992; WITHROW 1996; ZACHOS et al. 1999).
Da jedoch zum Zeitpunkt der klinischen Manifestation des Primärtumors bei bereits 98% der Tiere auf hämatogenem Wege eine
okkulte Metastasierung stattgefunden hat (DERNELL 2001), müssen außerdem zusätzliche therapeutische Maßnahmen zum Einsatz kommen, um die Überlebensrate signifikant zu verbessern bzw. um auf
palliativem Wege eine gewisse Lebensqualität zu erlangen und für einen bestimmten Zeitraum zu erhalten. Tabelle 12 beschreibt vereinfacht dargestellt die durchschnittlichen Ergebnisse von
Behandlungsprotokollen verschiedener Studien zum Thema Chemotherapie beim Osteosarkom hinsichtlich der Überlebenszeit.

Werden die Tiere lediglich einer Amputation unterzogen und werden keine weiteren Behandlungen durchgeführt, so kann nicht mehr als eine mittlere Überlebenszeit von 3–5 Monaten, bei einer ein- und zweijährigen Überlebenszeit von 11,5% und 2,0% erzielt werden. Bedingt durch die Beschwerden, die durch die klinisch auffällig gewordenen Metastasen hervorgerufen werden, müssen die Tiere auf Wunsch ihrer Besitzer in Folge euthanasiert werden (BRODERY et al. 1969; SHAPIRO et al. 1988; SPODNICK et al. 1992; ZACHOS et al. 1999).
Die Neigung zur Metastasierung, der Zeitpunkt der Diagnose und des Auftretens, das Ausmaß und die Lokalisation der Metastasen bleiben jedoch in jedem Fall der limitierende Faktor für ein erfolgreiches Management dieser Erkrankung.
Bei 10 –20% der Patienten sind bereits zum Zeitpunkt der Vorstellung des primären Krankheitsgeschehens demonstrierbare, sichtbare Metastasen nachzuweisen (WITHROW 1998). Die restlichen 80–90% der Patienten haben in der Regel zu diesem Zeitpunkt schon Mikrometastasen entwickelt. Diese sind vornehmlich in der Lunge, aber auch in anderen Geweben lokalisiert und treten erst klinisch in Erscheinung, wenn der Primärtumor entfernt wird.
Werden also nach dem chirurgischen Eingriff in den dazugehörigen regionalen Lymphknoten Metastasen entdeckt, muss mit einer entsprechend schlechten Prognose gerechnet werden (CAMPANACCI et al. 1981; GIULIANO et al. 1984; BACCI et al. 1987; O’BRIEN et al. 1993; OGILVIE et al. 1993; DOWNEY 1999; DERNELL 2001).
Metastasen, die zum Zeitpunkt der ersten Präsentation des Krankheitsgeschehens bereits klinisch manifest sind, aber auch Metastasen, die nach einer erfolgten chemotherapeutischen Behandlung auftreten, erweisen sich für gewöhnlich als chemotherapieresistent und führen damit zu einer dementsprechend ungünstigen Prognose (OGILVIE et al. 1993; WITHROW 1998).
In einer Studie erzielten 90 Hunde mit einem Osteosarkom Grad III, die Standartprotokollen mit einem chirurgischen Eingriff und
einer adjuvanten Chemotherapie unterzogen wurden, lediglich eine mittlere Überlebenszeit von 76 Tagen (BOSTON et al. 2006). Interessant an dieser Studie ist jedoch, dass die Tiere, die zusätzlich
eine palliative Radio- und Chemotherapie erhielten, eine deutlich längere Überlebenszeit (130 Tage) erreichten. Tiere, die lediglich operiert wurden, erzielten die geringste MST mit 3 Tagen.
Hunde mit Knochenmetastasen hatten eine längere Überlebenszeit aufzuweisen als die mit Weichteilmetastasen.
Eine retrospektive Studie über 228 Hunde beschäftigte sich mit dem Auftreten von Lymphknotenmetastasen des Osteosarkoms und deren Auswirkungen auf die Prognose (HILLERS et al. 2005). Lymphknotenmetastasen scheinen demnach beim Osteosarkom selten aufzutreten. Lediglich 4,4% der Fälle waren davon betroffen. Bei ihrem Auftreten ist jedoch mit einer deutlich schlechteren Prognose zu rechnen.
Nach einem chirurgischen Eingriff mit adjuvanter Chemotherapie betrug das MDFI bei den Tieren ohne Lymphknotenmetastasierung im Mittel 238 Tage mit einer MST von 318 Tagen. Das MDFI der Tiere mit einer Lymphknotenmetastasierung betrug im Mittel 48 Tage und die MST 59 Tage.
Daher besteht das derzeitige Behandlungsziel vorrangig darin einen möglichst langen erkrankungs- bzw. beschwerdefreien Zeitraum und eine damit verbundene verlängerte Überlebenszeit zu erzielen. Die Chance auf eine Heilung der Erkrankung ist durch die hohe Rezidiv- und Metastasierungsrate des Osteosarkoms und seiner damit ausgeprägten aggressiven Potenz äußerst gering, obwohl in Einzelfällen von spontanen Regressionen berichtet wird (MEHL et al. 2001).
Etwa 50% der Patienten, die einem Limb-Sparing unterzogen wurden, erleiden eine Wundinfektion (DERNELL et al. 1998; DEVITT et al. 1996).
Dieser Umstand muss hinsichtlich des Auskommens als prognostisch positiv bewertet werden. Die Tiere, die eine Wundinfektion haben,
zeigen eine deutlich geringere Tendenz zu örtlichen Rezidiven. Zu diesem Ergebnis kommt eine Studie mit 47 Hunden, die einer Limb-Sparing Prozedur am Radius unterzogen wurden. In dieser Studie
zeichnete sich ebenso die Tendenz ab, dass ein leichteres Körpergewicht sowie ein geringere Tumorgröße die Prognose verbessern können (LASCELLES et al. 2005).
In einer Studie mit 162 Tieren an verschiedenen Instituten zeigte sich, dass Hunde, die unter 5 Jahre alt waren, einen schlechteren
Krankheitsverlauf hatten als ältere Hunde (SPODNICK et al. 1992). Andere Studien beschreiben große Tumoren (MISDORP und HART 1979; KUNTZ et al. 1998) und den Sitz am Humerus (BROSTRÖM 1982) als
Zeichen für einen schlechten Verlauf. Die Größe des Tumors steht auch beim Menschen im Verhältnis zur Prognose (BROSTRÖM et al. 1982). Bezogen auf die anatomische Lage bestehen nach wie vor die
besten Vorraussetzungen, wenn der Prozess am Unterkiefer lokalisiert ist (STRAW et al. 1996). Als positiv zu beurteilen sind Osteosarkome an flachen Knochen, eine kleine Körpergröße, ein relativ
geringer Zerstörungsgrad des Gewebes sowie eine erfolgreiche vollständige Exzision des Tumorgewebes (HAMMER et al. 1995).
4. THERAPIE
4.1. GRUNDSÄTZLICHES ZUR THERAPIE
Bezüglich des Erkrankungsstadiums und der Ausbreitungscharakteristika sind aus Sicht des Therapeuten zu unterscheiden: 1. das lokalisierte Osteosarkom (ohne Nachweis von Metastasen) 2. das Osteosarkom mit nachgewiesenen Lungenmetastasen 3. das Osteosarkom mit extrapulmonalen Metastasen 4. das Osteosarkom-Rezidiv Therapieziele Ein kurativer Therapieansatz im engeren Sinne ist nur beim lokalisierten Osteosarkom ohne Metastasennachweis gegeben. Aufgrund der verfügbaren hochpotenten Chemotherapie kann auch bei Patienten mit Lungenmetastasen unter Umständen eine kurative Zielstellung aufrechterhalten werden. Beim extrapulmonal metastasierenden Osteosarkom besitzt die Therapie von vornherein einen palliativen Charakter (ENDICOTT 2003).
Therapiemodalitäten
Der Chirurg kann zwischen einer operativen Therapie (weite oder radikale Resektion nach ENNEKING) in Verbindung mit oder ohne adjuvanter Therapie, v. a. der antineoplastischen Chemotherapie wählen. Das Mittel der Wahl beim Hund ist Cisplatin in Kombination mit folgenden Medikamenten: First line: Doxorubicin, Cisplatin; second line: Carboplatin.
Therapieablauf bei kurativer Therapie
Aufgrund der hohen Rate okkulter, insbesondere pulmonaler Metastasen, aber auch zur besseren Abgrenzung des Primärdefektes sollte
die Behandlung mit einer neoadjuvanten aggressiven Polychemotherapie beginnen (ROSEN 1982; REMAGEN et al. 1983; WINKLER et al. 1984; ROSEN 1986; LARUE et al. 1989; BIELING et al. 1991; STRAW et
al. 1991; O’BRIEN et al. 1 993; WITHROW et al. 1993; BERG et al. 1995; KALIFA et al. 1995; WITHROW 1998).
Im zeitlichen Abstand folgt die operative Behandlung. Extremitätenerhaltende Eingriffe sind in vielen Fällen möglich – die onkologische Qualität (=Radikalität) des operativen Eingriffes besitzt jedoch Vorrang gegenüber dem Funktionserhalt. Anschließend wird die Chemotherapie fortgesetzt (adjuvante Chemotherapie). Beim Vorliegen pulmonaler Metastasen sollte ca. 6 Wochen nach dem Primäreingriff die bilaterale thorakale Exploration und Resektion der Metastasen erfolgen. Eine Strahlentherapie kommt beim Osteosarkom aufgrund der geringen Sensibilität nicht in Betracht.
Therapieablauf bei palliativer Therapie
Bei einem generalisierten Tumorleiden mit extrapulmonalen Metastasen , einem Primärtumorsitz am Körperstamm und/oder einem inoperablen Primärtumor bzw. einem Osteosarkomrezidiv ist aufgrund der schlechten Prognose nur eine palliative Therapie möglich (OGILVIE et al. 1993; WITHROW 1998; DERNELL et al. 2000; GREEN et al. 2002; HILLERS et al. 2005; BOSTON et al. 2006). Dabei steht die Wahrung der Lebensqualität (Schmerzlinderung, Funktionserhalt) im Vordergrund.
Ablative operative Eingriffe sind in diesen Fällen nur selten indiziert. In Abhängigkeit von der Gesamtsituation des Patienten können auch operative Eingriffe durchgeführt werden (ggf. Tumormassenreduktion, im Einzelfall Resektion von Metastasen, Therapie und Prophylaxe von Komplikationen). Hier kann die Strahlentherapie sinnvoll zum Einsatz kommen (HEIDNER et al.1991; MCENTEE et al. 1993; POWERS et al. 1996; STRAW et al. 1996; MUELLER et al. 2005).
4.2. KURATIVE THERAPIE
Der kurative Ansatz in der Behandlung des Osteosarkoms liegt vor allem im operativen Eingriff, muss aber hinsichtlich des Auskommens durch eine adjuvante und neoadjuvante Behandlung unterstützt werden.
4.2.1. OPERATIVE THERAPIE
Ein kurativer Erfolg bezüglich der Behandlung des Osteosarkoms kann nur in Verbindung mit einem chirurgischen Eingriff erzielt werden (BRODERY et al. 1969; MADEWELL et al. 1978; SHAPIRO et al. 1988; SPODNICK et al. 1992; WITHROW 1996; ZACHOS et al. 1999). Dieser Umstand wird vor allem dadurch bedingt, dass das Osteosarkom sich durch seine sehr hohe lokale Rezidivrate als äußerst aggressiv erweist.
Frühere Arbeiten, in denen versucht wurde beim Osteosarkom des Hundes auf konservativem und unblutigem Wege einen Behandlungserfolg zu erzielen, erwiesen sich hinsichtlich der Überlebens- und Rezidivrate generell als erfolglos (WITHROW 1998).
Ein operativer Eingriff sollte und kann nur unter bestimmten Voraussetzungen erfolgen (BERG 1996):

4.2.1.1. GRUNDSÄTZLICHES ZU CHIRURGISCHEN EINGRIFFEN IN DER ONKOLOGIE
Um den Eingriff in möglichst geringem Rahmen und die Rezidivrate gering zu halten, muss vor jedem lokaltherapeutischen Eingriff bei einem Tumor vorab geklärt werden, wo und mit welcher Ausdehnung der Tumor gewachsen ist.
4.2.1.1.1. DAS ANATOMISCHE KOMPARTMENT
Das Verhältnis des Tumors zum anatomischen Kompartment und dessen Ausbreitung ist für die Operationsplanung von entscheidender Bedeutung. Tumore werden danach eingeteilt, ob sie innerhalb eines Gewebekompartments gewachsen sind oder sich aus diesem heraus ausdehnen.
Nach ENNNEKING (1984, 1986, 1989) ist das Kompartment ein Raum, der durch natürliche Barrieren den Tumor begrenzt. Die natürliche
Begrenzung erfolgt durch den kortikalen Knochen, durch den Gelenkknorpel und die Gelenkkapsel, durch Sehnen und Sehnenscheiden, durch Faszien und Muskelsepten und durch funktionelle
Muskelgruppen. Intrakompartmentelle Räume sind zu allen Seiten in sich geschlossen wie der parossale Raum (Kortikalis-Faszie-Sehnenansätze). Extrakompartmentelle Räume sind zu einer oder zwei
Seiten geöffnet wie die Axilla und die Fossa poplitea. Extrakompartmentelle Tumoren gehen vom Gewebe des extrakompartmentellen Raumes aus oder sind zunächst intrakompartmentell gewachsen, dann
aber aus dem Ursprungskompartment herausgewachsen. Ein Tumordurchbruch findet vor allem dort statt, wo eine Gefäßperforation möglich ist. Am Knochen kann der Tumor im Bereich der Meta- bzw.
Epiphyse, der Sehnenansätze, im Ursprungs- und Ansatzbereich der Gelenkkapsel, der Synovialis und dem Ansatz der Gelenkbänder sehr leicht aus dem spongiösen Knochen herauswachsen. Barrieren gegen
das Durchwachsen des Tumors sind vor allem der Gelenkknorpel, aber auch Faszien, Aponeurosen, Sehnen und Sehnenscheiden. Ein Tumor kann die natürliche Barriere nicht nur durch eine
Gefäßperforation durchbrechen, sondern auch durch die gewebeproliferative Kraft der reaktiven Zone, möglicherweise wird er durch Tumor-Angiogenesefaktoren stimuliert.
Ein Tumor wird auch als extrakompartmentell wachsend eingestuft, wenn auf der anderen Seite der Barriere ein reaktives Geschehen nachzuweisen ist (LARUE 1986; ENNEKING 1989; LEIBMAN et al. 2001).
Ein extrakompartmentell gewachsener Tumor führt zu einer erbeblich schlechteren Prognose als ein intrakompartmentell gewachsener
Tumor. Die Gefahr eines postoperativen Rezidivs ist bei einem extrakompartmentell gewachsenen Tumor deutlich höher (STRAW et al. 1990; SPODNICK et al. 1992; BERG 1996). Daher muss ein
chirurgischer Eingriff bei einem extrakompartmentell gewachsenen Tumor deutlich drastischer angesetzt werden. Führt die anzuwendende Radikalität eines chirurgischen Eingriffes zu der Annahme,
dass postoperativ weder eine ausreichende Funktionaliät noch eine akzeptable Lebensqualität gewährleistet werden kann, so muss ein extrakompartmentell gewachsener Tumor als inoperabel angesehen
werden.
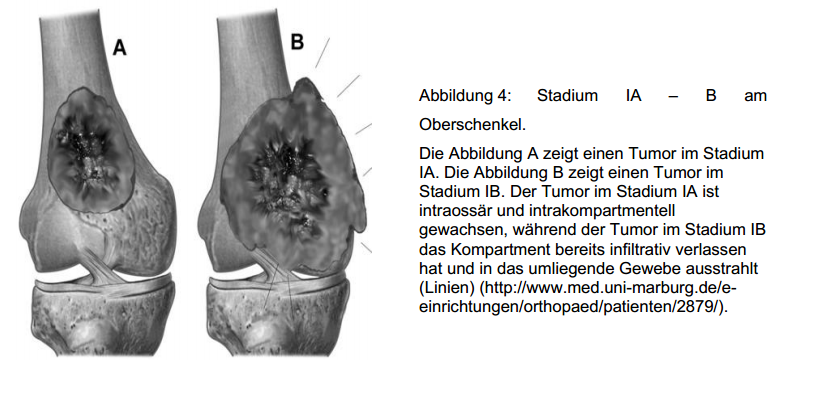
Durch den Einsatz neoadjuvanter Therapieverfahren ist es möglich, einen extrakompartmentell gewachsenen Tumor in seinen
ursprünglichen intrakompartmentellen Raum zurückzudrängen (ROSEN 1982; REMAGEN et al. 1983; WINKLER et al. 1984; ROSEN 1986; LARUE et al. 1989; BIELING et al. 1991; STRAW et al. 1991; O’BRIEN et
al. 1993; WITHROW et al. 1993; BERG et al. 1995; KALIFA et al. 1995; WITHROW 1998). Dieser Vorgang wird als „downstaging“ bezeichnet. Das „downstaging“ eines Tumors führt zu einer Verkleinerung
und einer Nekrose von Tumorgewebe, zu einer Eliminierung von Satelliten- und Mikrometastasen und zu einer verbesserten Abgrenzung des Tumors zum umliegenden Gewebe. Mit dem erfolgreichen Einsatz
neoadjuvanter Therapieverahren kann die Radikalität eines chirurgischen Eingriffes deutlich herabgesetzt werden und damit die Gefahr einer Rezidivbildung minimiert werden. Es kann insgesamt mit
einer deutlich verbesserten Prognose gerechnet werden.
4.2.1.1.2. TUMORWACHSTUM, PSEUDOKAPSEL UND REAKTIVE ZONE
Das Wachstum eines Tumors verläuft immer in zentripetaler Form, wobei es durch den raumfordernden Prozess zu einer Kompression des umliegenden Gewebes und zu einer Ausbildung einer Art Pseudokapsel aus reifem, fibrösen Bindegewebe kommt (HOLLEB et al. 1991). Wird schließlich eine Faszie erreicht, bildet sich eine echte Pseudokapsel, die sich im Anschluss durch weiteres Wachstum unterschiedlich weit ausstülpt. Diese Ausstülpungen führen zu einer Septen- und Läppchenbildung. Die feine Pseudokapsel eines intraossären Knochentumors geht vom Knochenmark, dem Endost und dem Periost aus. Das Wachstum erfolgt entlang der Knochentrabekel und der Haversschen Kanäle. Durch die ungleichmäßige Ausdehnung zwischen den Trabekeln nimmt ein intraossär gewachsener Knochentumor eine unregelmäßige Oberflächenstruktur ein.
Um die Pseudokapsel des Tumors bildet sich eine reaktive Zone. Diese kann mikroskopisch nicht von einer Entzündung unterschieden werden (MOULTON 1990). Sie besteht aus proliferierenden Mesenchymzellen und Gefäßneubildungen in Verbindung mit Infiltrationen aus Entzündungszellen. Ebenso können Mikro- oder Satellitenmetastasen in der reaktiven Zone auftreten. Sowohl die Zellproliferation als auch die Gefäßsprossungen sind unspezifisch und hängen von dem Gewebe ab, in dem sie sich befinden. Die mesenchymalen Zellen besitzen im Weichteilbereich einen fibrinösen Charakter und im Knochenbereich einen knöchernen Charakter.
Der Proliferationsprozess ähnelt im Knochengewebe dem der Frakturheilung und im Weichgewebe dem der Narbenbildung und ist damit
oftmals diagnostisch von unspezifischen Prozessen schlecht abzugrenzen (MOULTON 1990). Die Gefäße sind normal aufgebaut und verlaufen innerhalb der Kapsel entlang der Septen um sich als
Kapillaren im Tumor zu verteilen. Die Entzündungsreaktion beinhaltet Endzündungszellen, Ödem und Fibrin. Es sind die gleichen Bestandteile, die man bei der Wundheilung beobachtet. Perivaskuläre
Knoten bilden sich an den Blutgefäßen, bestehend aus unreifen und immunkompetenten B- und T-Lymphozyten sowie Plasmazellen. Je aggressiver sich die Läsion verhält, desto intensiver sind diese
Zellcluster in der reaktiven Zone angesammelt.
4.2.1.1.3. THERAPEUTISCHES VORGEHEN IN ABHÄNGIGKEIT VOM TUMORSTADIUM
Es ist notwendig, den Tumor möglichst im Gesunden zu entfernen. Damit erhöht sich mit steigendem Tumorstadium die erforderliche
Radikalität des Eingriffs. Der Anspruch des Patienten nach möglichst hoher Funktionalität und Lebensqualität sowie guter Kosmetik muss eindeutig der aus onkologischer Sicht erforderlichen
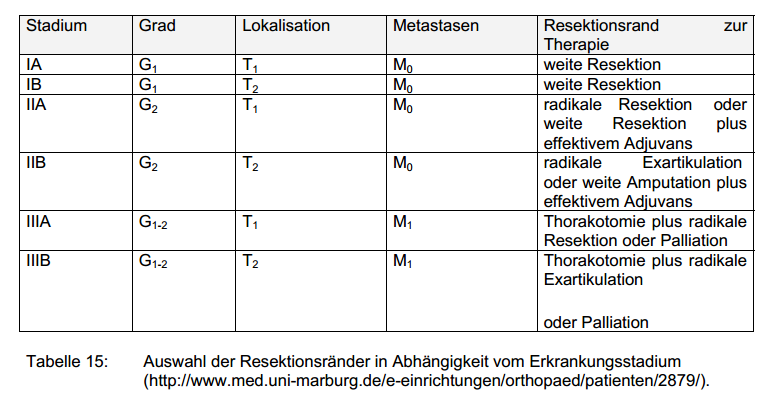
Radikalität der Operation unterstellt werden. ENNEKING unterscheidet (1988) vier Typen von Resektionsrändern aufgrund ihrer makroskopischen und mikroskopischen Grenzen zwischen dem kranken und
gesunden Gewebe. Er geht dabei von einem Tumormodell aus, das aus einem Tumor mit Pseudokapsel und einer unterschiedlich breiten reaktive Zone besteht, in der sich Satellitenmetastasen befinden
können. Das anatomische Kompartment in dem sich diese Tumoreinheit befindet, wird durch Knochen- und Fasziengewebe abgegrenzt. Sogenannte Skip-Läsionen können außerhalb des anatomischen
Kompartments auftreten. Der Resektionsrand kann intraläsonal, marginal, weit und radikal gewählt werden.

Alle vier Maßnahmen können sowohl als Amputation oder Limb-Sparing Eingriff durchgeführt werden. Beim Osteosarkom kommt aufgrund der
hohen Aggressivität nur eine weite oder eine radikale Resektion in Betracht. Es muss auf jeden Fall eine vollständige Entfernung des Tumors mitsamt seiner reaktiven Zone erzielt
werden.
Bei einer weiten Resektion verläuft die Resektionsebene durch gesundes Gewebe im Kompartment des Tumors. Eine radikale
Resektion führt zu einer vollständigen Resektion des gesamten Kompartments des Tumors mit allen befallenen Knochenund Weichteilanteilen. Bei einem Knochentumor bedeutet das, dass der gesamte
befallene Knochen inklusive infiltriertem Gewebe entfernt werden muss. Die therapeutische Vorgehensweise muss dem Tumorstadium angepasst werden. Nur so kann ein ausreichender Sicherheitsabstand
eingehalten und eine entsprechende Prognose aufrechterhalten werden. Eine Studie, die sich mit der lokalen Tumorkontrolle nach Resektion von malignen Tumoren in verschiedenen Resektionsebenen
beschäftigte, kam zu dem Ergebnis, dass eine weite Resektion von bösartigen Sarkomen zu keinem Lokalrezidiv (0%) führte, während eine Resektion in intraläsionaler oder marginaler Grenze eine
Rezidivrate von 37% aufwies (VIRKUS et al. 2002). Damit alle Tumorbestandteile chirurgisch erfasst werden können, wird für Tumoren in verschiedenen Stadien eine zunehmende Radikalität des
Eingriffes erforderlich:
4.2.1.2. CHIRURGISCHER ANSATZ BEIM OSTEOSARKOM
Um in erster Linie tierschutzrechtlichen Bedingungen gerecht zu werden, ist in der operativen Therapie des Osteosarkoms der
Funktionserhalt und die postoperative Lebensqualität des Patienten von zentraler Bedeutung. Diese hängt von der Lokalisation des Tumors und dessen Ausdehnung, also dem Stadium der Erkrankung und
der Konstitution des Patienten ab. Die Radikalität des Eingriffes wird damit durch den Tumor bestimmt.

Bei größen- und lagebedingter Inoperabilität eines Tumors, aber auch zu einer Absenkung der Radikalität eines Eingriffes, kann durch
neoadjuvante Therapieverfahren versucht werden, das Tumorstadium abzusenken (Tumor– Downstaging) (ROSEN 1982; REMAGEN et al. 1983; WINKLER et al. 1984; ROSEN 1986; LARUE et al. 1989; BIELING et
al. 1 991; STRAW et al. 1991; O’BRIEN et al. 1993; WITHROW et al. 1993; BERG et al. 1995; KALIFA et al. 1995; WITHROW 1998).
So können IIB Tumoren zu IIA Tumoren oder Stadium III Tumoren in Stadium II Tumoren reduziert werden und damit die Möglichkeit für die Anwendung gliedmaßenerhaltender Verfahren geschaffen werden. Bei besonders aggressiven high-grade Tumoren können die Pseudokapsel und die reaktive Zone sehr schwach ausgeprägt sein oder sichtlich fehlen. Neoadjuvante Techniken führen hier zu einer Verdickung von Pseudokapsel und reaktiver Zone, damit auch zu einer deutlicheren Abgrenzung des Defektes und einer verbesserten Operabilität des Defektes.
Für die operative Behandlung von high-grade Tumoren kann nur eine weite oder radikale Resektion in Verbindung mit einer adjuvanten Therapie in Betracht gezogen werden, da aufgrund des unklaren Ausmaßes der reaktiven Zone und dem möglichen Auftreten von Satellitenmetastasen mit einem Rezidiv zu rechnen ist (STRAW et al. 1990; SPODNICK et al. 1992; BERG 1996). Um größtmögliche Heilungschancen zu erhalten, muss der Defekt vollständig entfernt werden. Lowgrade Tumoren wie beispielsweise das parossale Osteosarkom sind intrakompartmentell gewachsen. Hier kann eine weite Resektion ohne adjuvante Behandlung versucht werden.
4.2.1.2.1. TUMORLOKALISATION GLIEDMAßE
Ist der Primärtumor im Bereich einer Gliedmaße lokalisiert, haben sich zwei Methoden bewährt: Eine radikale Amputation oder ein weiter oder radikaler LimbSparing Eingriff (gliedmaßenerhaltende Chirurgie). Beide Eingriffsmethoden führen bei gleicher chemotherapeutischer Begleitung zu einer vergleichbaren Überlebensrate.
Zu diesem Ergebnis kam man in einer vergleichenden Studie mit insgesamt 490 Hunden, von denen 220 einer Amputation unterzogen und 270 mit einem LimbSparing Eingriff behandelt wurden (STRAW et al. 1996). Zum selben Ergebnis kommt DERNELL (2001) in einer jüngeren Studie, in der er Hunde verglich, die einer Cisplatinbehandlung mit Amputation oder Limb-Sparing unterzogen wurden.
4.2.1.2.1.1. AMPUTATION
Aufgrund der ausgeprägten Malignität des Tumors und seiner hohen Rezidivrate, muss ein ausreichender Sicherheitsabstand für die Entfernung des Tumors angesetzt werden, dieses Ziel wird mit einer radikalen Resektion der betroffenen Gliedmaße vollständig erreicht. In der Regel wird amputiert, aber auch exartikuliert oder die ganze Gliedmaße im Ansatz entfernt wie bei einer Schultergürtelresektion oder einer Hemipelvektomie. Der Vorteil liegt auf der Hand: Die radikale Resektion ist verhältnismäßig einfach und mit wenig Aufwand durchzuführen, sie verhält sich für den Besitzer kosteneffektiv und die Heilung der Wunde verläuft in der Regel komplikationslos. Die Tiere kommen mit einer funktionellen Kompensation sehr gut zu recht (DERNELL 2001; WITHROW 1998; STRAW et al. 1996).
Voraussetzungen
Die Grundvoraussetzung für einen derartigen Eingriff ist eine gründliche Voruntersuchung, da bestehende schwere orthopädische und/oder neurologische Schäden durchaus ein ernsthaftes Problem für das Auskommen darstellen können (WITHROW 1998; DERNELL 2001). Der Hund muss in der Lage sein, diesen Eingriff konditionell zu verkraften und sein Leben auf drei Beinen bestreiten zu können. Das heißt, er muss den Eingriff kompensieren können. Unter diesen Umständen kann ein derartiger Eingriff auch bei größeren und schwereren Hunden mit Erfolg durchgeführt werden (STRAW et al. 1996).
Vor einem radikalen Eingriff bestehende degenerative Gelenkerkrankungen, wie sie bei den meisten älteren großrahmigen Hunden bekannt sind, können kaum als Kontraindikation verstanden werden. Die meisten Hunde kompensieren schnell. Die durch die stärkere Belastung hervorgerufene beschleunigte Degeneration der verbliebenen Gliedmaßen stellt sich, im Verhältnis zu den sonstigen Problemen, meistens als klinisch irrelevant heraus (BERG 1996).
Technik
Ist der Primärtumor an der Vordergliedmaße lokalisiert, wird generell eine komplette Amputation der Vordergliedmaße empfohlen (STRAW
et al. 1996; DERNELL 2001). Als Alternative kann bei Hunden, bei denen der proximale Teil der Scapula betroffen ist, eine Scapulektomie in Betracht gezogen werden (ENNEKING 1984; KIRPENSTEIJN et
al. 1994; TROUT et al. 1995). Mit einer partiellen Skapulektomie bleibt die Funktionsweise der Gliedmaße gut erhalten, eine vollständige Entfernung mit Disartikulation des Schultergelenkes kann
jedoch zu Gang- und Haltungsschwierigkeiten führen, die im weiteren Verlauf durch eine postoperative Physiotherapie begleitet
werden müssen (KIRPENSTEJN et al. 1994; DERNELL 2001). Eine subtotale Scapulektomie unter Erhalt des Scapulohumeralgelenkes wurde bei mehreren Hunden im durchschnittlichen Alter von 8,4 Monaten
beschrieben. Das funktionelle Auskommen wurde als gut bewertet (NORTON et al. 2006).
Ist der Primärtumor an der Hintergliedmaße lokalisiert, wird die Gliedmaße in Abhängigkeit des Sitzes der Läsion und dem chirurgischen Können des Operateurs, im Bereich des proximalen Drittels des Femurs per Osteotomie abgesetzt (STRAW et al. 1996) oder besser unter Disartikulation des Hüftgelenkes entfernt (STRAW et al. 1996; DERNELL 2001). Sitzt der Tumor am proximalen Ende des Femurs oder haftet er dem Becken an, kann er nur durch eine Hemipelvektomie sinnvoll entfernt werden (STRAW et al. 1990 und 1992; DERNELL 2001).
Betrifft er nur den proximalen Teil des Femurs, ist zumindest eine Amputation mit Acetabuloektomie durchzuführen, um in den
proximalen Weichteilgeweben einen ausreichenden Sicherheitsabstand gewährleisten zu können (DERNELL et al. 2001).
Diese Höhe des Eingriffes garantiert eine möglichst vollständige örtliche Entfernung des Prozesses und stellt sich sowohl kosmetisch als auch funktionell als beste Lösung dar. Kleine Primärtumoren der Ulna können durch eine teilweise Ulnektomie entfernt werden, eine Rekonstruktion mit Transplantaten oder Knochensubstanz kann dann unterbleiben. Sind die Mittelfußknochen betroffen, können örtliche Resektionen oder Amputationen durchgeführt werden. Kleine Hunde kommen mit der Entfernung der beiden medialen oder lateralen Zehen gut zurecht. Es zeigte sich, dass auch die Entfernung der mittleren zwei Mittelfußknochen gut toleriert wird. Derartige Entfernungen an großen Hunden wurden bis dato jedoch noch nicht beschrieben (DERNELL 2001).
Komplikationen
Obwohl eine Amputation einen erheblichen Eingriff darstellt, treten nur wenige Komplikationen auf, wenn der Eingriff sorgfältig und sachgerecht durchgeführt wird (STRAW et al. 1996). Blutverluste und Infektionen stellen das hauptsächliche Risiko dar, seltener werden Embolien oder postoperative dilatationsbedingte Darmverschlingungen beschrieben. Lokale Rezidive sind selten zu erwarten. Treten diese auf, dann in der Regel nach einer teilweisen Amputation zum Beispiel bei der Osteotomie am Femur. Es sind dann Tumorzellen im Weichteilgewebe oder im Knochenmarkskanal verblieben, die zu einem Rezidiv führen. Ist mit diesem Risiko aufgrund der proximalen Lage eines Tumors zu rechnen, wählt man daher besser die Disartikulation in einem Gelenk als die Osteotomie eines Knochens (STRAW et al. 1996). Für kurze Zeit können starke Schmerzen auftreten. Durch entsprechende Behandlung mit systemischen und lokalen Schmerzmitteln können diese gelindert werden. Die meisten Hunde können am Tag nach der Operation bereits wieder laufen, auch wenn sie unter Umständen zunächst gestützt werden müssen. Die Rekonvaleszenzdauer und die Dekompension der Dreibeinigkeit hängen von der Kondition, der Größe und dem Gewicht der Tiere ab. Selbst große und sehr große Hunde sollen aber gut mit der Amputation einer Gliedmaße zurecht kommen und die meisten Besitzer sind zufrieden mit der Mobilität sowie der wiedergewonnenen Lebensqualität ihrer Tiere nach dem Eingriff (WITHROW und HIRSCH 1979; CARBERRY und HARVEY 1987).
Prognose
Betrachtet man das gesamte Erkrankungsbild des Osteosarkoms, birgt eine alleinige Amputation ohne begleitende
Behandlungstechniken hinsichtlich der Überlebenszeit keinen signifikanten Vorteil (BRODERY et al. 1969; SHAPIRO et al. 1988; SPODNICK et al. 1992; ZACHOS et al. 1999). Die Lebensqualität der
Tiere wird jedoch, wenn auch nur für kurze Zeit hervorragend verbessert und größtenteils wiederhergestellt. Dieser Zustand bleibt ohne weitere klinische Symptome erhalten, bis die bereits
vorhandenen Mikrometastasen zum Teil enorme Ausmaße angenommen haben. Ab dem Zeitpunkt der klinischen Manifestation der Metastasierung fallen die klinischen Symptome derart heftig aus, dass die
Entscheidung zur Euthanasie leicht getroffen wird (BERG 1996).
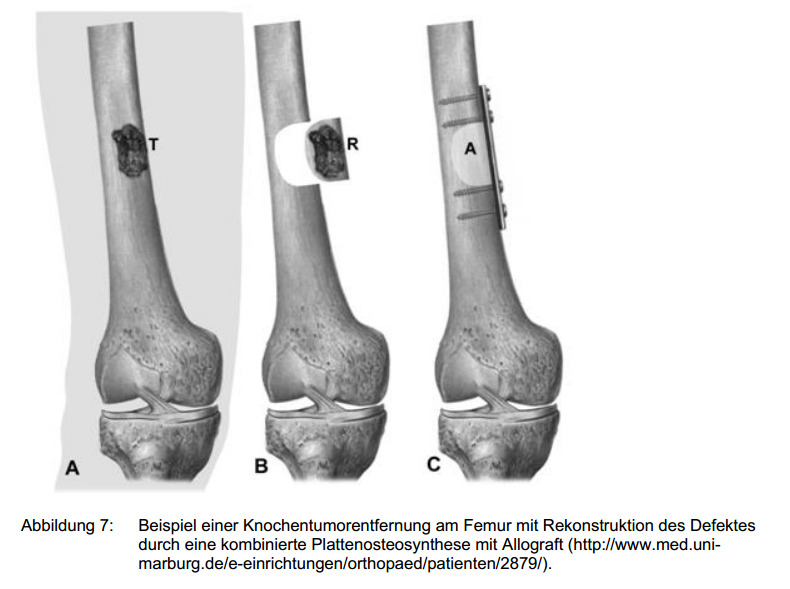
4.2.1.2.1.2. LIMB-SPARING
Die meisten Tiere kommen gut mit einer Gliedmaßenamputation zurecht. Unter bestimmten Umständen kann es jedoch erforderlich werden, gliedmaßenerhaltende Eingriffe durchzuführen, wenn zum Beispiel die Tiere erhebliche orthopädische oder neurologische Schäden aufweisen, sehr groß sind oder die Besitzer eine Amputation nicht zulassen. Unter dem Begriff Limb-Sparing wird ein Eingriff verstanden, bei dem der erkrankte Bereich einer Gliedmaße chirurgisch entfernt und der entstandene Defekt mit einem Transplantat behoben wird. Die Gliedmaße und ihre Funktion bleiben somit erhalten. Limb-Sparing ist ein komplexer und komplizierter Eingriff. Eine erfolgreiche Durchführung ist nur mit hohem Material und Personalaufwand möglich und setzt eine gute Versorgung mit Prothesen bzw. eine Knochenbank sowie ein gut eingespieltes Team aus Chirurgen, Onkologen, Pathologen, Radiologen und technischem Hilfspersonal voraus, um den kurativen Therapieansatz aufrecht zu erhalten (DERNELL et al. 2001).
Voraussetzungen
Geeignete Kandidaten sind Hunde mit gutem Allgemeinbefinden, bei denen sich der Primärtumor an einer Gliedmaße befindet und nicht
mehr als 50% des jeweiligen Knochens radiographisch in Mitleidenschaft gezogen sind (DERNELL et al. 2001; LEIBMAN et al. 2001). Am besten geeignet für Limb-Sparing Eingriffe sind die Patienten,
deren Tumorgeschehen sich auf den distalen Radius oder die die distale Ulna beschränkt und bei denen nur eine leichte bis mittelgradige Ausbreitung des Tumorgewebes ins Weichteilgewebe
stattgefunden hat und keine pathologische Fraktur vorliegt (DERNELL et al. 2001; WITHROW 1998; STRAW und WITHROW 1996).
Vor dem Eingriff ist es wichtig die Ausdehnung des Tumors genau zu erfassen, um einen entsprechenden Sicherheitsabstand gewähren zu können und damit eine mögliche örtliche Rezidivbildung von vornherein zu unterbinden. Die Messgenauigkeit der Radiographie und der Szintigraphie vor dem Eingriff wurde in einer bewertenden Studie anhand der histopathologischen Ergebnisse nach dem Eingriff evaluiert (LEIBMAN et al. 2001). Beide Verfahren führen demnach zu einer Überschätzung der Tumorausdehnung und gewährleisten damit einen ausreichenden Sicherheitsabstand.
Die Anwendung der Szintigraphie führt jedoch im Gegensatz zur Radiographie zu einer stärkeren Überschätzung des Ausmaßes des Tumors. Dieser Umstand muss beachtet werden, falls eine szintigraphische Betrachtung zu dem Schluss führen sollte, von einem Limb-Sparing Eingriff abzusehen.
Operative Rekonstruktionsmöglichkeiten
Aufgrund des präoperativen Ansprechens auf die neoadjuvante Therapie in Verbund mit den Fortschritten in der CT- und MRT-
Bildgebung, welche die anatomische Darstellung des Defektes erheblich präzisierten, waren in der Humanmedizin mit Beginn der 90er Jahre zwei Drittel der an Sarkomen erkrankten Patienten
onkologisch geeignete Kandidaten für extremitätenerhaltende Eingriffe (HAM et al. 1998; GETTY und PEABODY 1999; MUSCOLO et al. 2000; RENARD et al. 2000; VASTEL et al. 2000). Dieser Umstand machte
die Einführung verschiedener Rekonstruktionstechniken notwendig. Diese verfügen über unterschiedliche Einsatzmöglichkeiten mit verschiedenen Vor- und Nachteilen.
Rekonstruktive Eingriffe können eingeteilt werden, in jene für diametaphysäre (engl.: intercalary) Defekte in den Röhrenknochen, jene für den Ersatz eines entfernten Gelenkes und jene die konventionelle Amputationstechniken modifizieren.
Im Bereich der langen Röhrenknochen ist in fast allen Fällen eine zusätzliche Plattenstabilisierung notwendig, um den Defekt und das Substitut mechanisch zu stützen und damit die Heilung (engl.: creeping substitution) zu fördern. Die Verwendung von Zement behindert den Heilungsprozess nicht wesentlich, trägt aber zu einer deutlich verbesserten Stabilität bei. Unter seiner Verwendung treten wesentlich weniger orthopädische Schäden, Transplantatbrüche oder Schraubenlockerungen auf (STRAW et al. 1992; KIRPENSTEIJN et al. 1998).
Für etwa 3–4 Wochen ist zu beachten, dass die Tiere nur eingeschränkt bewegt werden dürfen. Nach Ablauf dieser Zeit können sich die
Tiere wieder frei und uneingeschränkt bewegen. Es bleibt jedoch unbedingt erforderlich, dass die Gliedmaße so früh wie möglich postoperativ einer gewissen Belastung ausgesetzt wird, damit es
nicht zu einer Versteifung der Gelenke kommt. Alles in allem kann die Funktion der Gliedmaße nach der Anwendung des Limb-Sparing als zufriedenstellend beurteilt werden, da bei bis zu 80% der
Tiere gute bis exzellente Ergebnisse erzielt werden konnten (STRAW und WITHROW 1996).
Die Möglichkeiten zur Rekonstruktion von diametaphysären Defekten bestehen in konventionellen autogenen Knochentransplantaten,
vaskularisierten autogenen Transplantaten und Fremdknochentransplantaten (engl.: allografts).
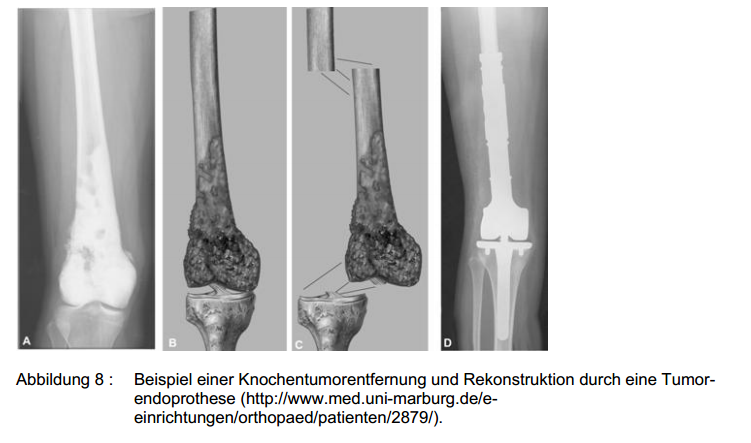
Werden aufgrund der anatomischen Ausbreitung des Tumors Gelenkstrukturen in die Resektion einbezogen, so können die entstandenen
Defekte durch verschiedene Rekonstruktionsmethoden angegangen werden. Falls es hinsichtlich der zu erwartenden Praktikabilität möglich ist, ist die einfachste Methode eine Arthrodese der nach der
Resektion übriggebliebenen Knochenanteile. Des Weiteren können sofern verfügbar Fremdknochen mit Gelenkanteil oder Prothesen eingesetzt werden. Eine weitere Option besteht in der Kombination von
Fremdknochen mit Prothesen (engl.: composite). Studien der Humanmedizin beschreiben für alle hier genannten rekonstruktiven Eingriffe eine Fünf-Jahres-Überlebensrate von 60% (HORNICEK et al.
1998; HAM et al. 1998; GETTY und PEABODY 1999; MUSCOLO et al. 2000; RENARD et al. 2000; VASTEL et al. 2000).
Die Rotations- oder Umkehrplastik stellte im Prinzip eine Modifikation der konventionellen Amputation für Läsionen im Knie- und
Hüftbereich dar, die durch spezielle Exoprothesen kompensiert wird (WINKELMANN 1996; HILLMANN et al. 1999).

Komplikationen können zu jedem Zeitpunkt während des Eingriffes, der Chemotherapie oder einer Bestrahlung auftreten.
Eine zu hohe Bestrahlung verkompliziert die Wund- und Transplantatheilung und vervielfacht die Gefahr einer Transplantatinfektion (THRALL et al. 1990).
Eine angepasste Bestrahlungsdosis in Kombination mit einem chirurgischen Eingriff und einer Chemotherapie kann jedoch äußerst hilfreich in der Eindämmung der örtlichen Prozesse sein. Dies spiegelt sich in der Nekroserate wieder (WITHROW et al. 1993; POWERS et al. 1996).
Es können Gefäß- und Nervenläsionen auftreten, aber auch Venenthrombosen oder eine Lungenembolie. Die hauptsächlichen Komplikationsgefahren hängen jedoch mit dem chirurgischen Eingriff zusammen. In einer Erhebung von 220 Limb-Sparing Fällen mittels der Kaplan-Meier-Kurve liegt die einjährige lokale freie Rezidivrate bei über 76% unter den 60% Überlebenden nach einem Jahr (STRAW und WITHROW 1996). Die Kontrolle des lokalen Geschehens kann wesentlich durch zusätzliche Behandlungen verbessert werden, zum Beispiel durch eine Vorbehandlung mit gemäßigten Strahlendosen und intraarteriellen Gaben von Cisplatin.
Wurde zum Zeitpunkt der Tumorentfernung OPLA-Pt implantiert, betrug die einjährige rezidivfreie Rate mehr als 90% unter den 63% Überlebenden (STRAW et al. 1993).
40 % aller Tiere erleiden eine Infektion des Transplantats. Die meisten davon können erfolgreich mit systemischer und/ oder ohne lokaler (Polymethylmethacrylat „PerlenSticks-Schaum“) Antibiotikagabe behandelt werden. Die Gliedmaßenfunktion ist trotz bestehender Entzündung selten gestört.
In einigen schwer zu kontrollierenden Fällen mussten Transplantate ausgewechselt werden oder die betreffende Gliedmaße amputiert werden (DERNELL et al. 1998). Unerwartet wurde festgestellt, dass diejenigen Tiere, die eine Infektion entwickelten, eine fast doppelt so hohe Überlebenschance hatten als die vermeintlich komplikationslos geheilten Hunde (DEVITT et al. 1996).
Mit der Technik ILP (isolated limb perfusion) ist es möglich, Chemotherapeutika in hohen Dosen oder zusätzliche Wirkstoffe, die
systemisch nicht toleriert werden wie den Tumornekrosefaktor, direkt in die betroffene Gliedmaße einzubringen. Der Effekt dieser Therapiemaßnahme kann durch die Anwendung des Verfahrens der
lokalen Hyperthermie verstärkt werden. Es sind verschiedene Grade von örtlicher Zytotoxizität bekannt, die von der Art des Arzneimittels abhängig sind. Über den erfolgreichen Einsatz von ILP beim
Hund wurde bereits berichtet (VAN GINKEL et al. 1995). In einer Studie wird über lokale Weichteil- und Neurotoxizität
berichtet (DERNELL et al. 1999).
Die Gründe hierfür sind noch unbekannt. Es ist jedoch wahrscheinlich, dass die bessere Heilung mit der Aktivierung von Immun-Effektorzellen und einer Antwort auf die Wirkung von Cytokinen wie Interleukine und des Tumornekrosefaktors (TNF) im Zusammenhang steht, deren Aktivierung und Freisetzung durch die chronisch bakterielle Entzündung induziert wurde (DERNELL et al. 2001).
Eine Isolation der Gliedmaßengefäße und eine Perfusion mit Chemotherapeutika (ILP) werden beim Menschen als Alleinbehandlung oder
zur Vorbereitung eines Limb-Sparing Eingriffes angewendet (CAVALIERE et al. 1987).
Begleitende Therapieverfahren
Bei einem derartigen Eingriff muss aufgrund der eingeschränkten Radikalität des Eingriffes immer mit einer möglichen lokalen Rezidivierung, aber auch mit einer Infektion und einer Metastasenbildung gerechnet werden. Um dieses Risiko zu minimieren, ist es erforderlich bestimmte zusätzliche Behandlungen durchzuführen.
Infektionen
Als Infektionsprophylaxe werden prä-, intra- und 24 Stunden postoperativ Cephalosporine der zweiten Generation intravenös verabreicht. In jedem Fall muss während des Eingriffes penibel aseptisch vorgegangen werden (DERNELL et al. 2001).
Prognose
An der California State University wurden bis zum Jahr 1996 mehr als 370 Operationen dieser Art durchgeführt. Die Gliedmaßenfunktion
stellte sich bei den meisten Hunden als gut bis exzellent dar und die Überlebensrate wurde durch die Entnahme des Primärtumors mit Randresektion, im Gegensatz zur radikalen Abgrenzung durch eine
Amputation, nicht nachteilig beeinflusst (STRAW et al. 1996). Die Funktionsfähigkeit der Gliedmaße nach einem Limb-Sparing Eingriff und einer Karpalarthrodese wird als gut beschrieben. Eine
Arthrodese des Schultergelenkes, des Hüftgelenkes, des Knie- oder Sprunggelenkes führte nur zu unbefriedigenden Ergebnissen und einer eingeschränkten Funktionstüchtigkeit (KUNTZ et al. 1998;
HUBER et al. 1998).
4.2.1.2.2. TUMORLOKALISATION STAMMSKELETT
Ist der Primärtumor im Kopfbereich lokalisiert, wird eine vollständige Mandibulektomie oder Maxillektomie empfohlen (SCHWARZ et al. 1991; WHITE 1991; KOSOVSKY et al. 1991; WALLACE et al. 1991; DERNELL et al. 1996).
Zufriedenstellende Ergebnisse wurden auch in einer Studie über die Anwendung einer teilweisen Mandibulektomie und Maxillektomie erzielt. 84% der Besitzer zeigten sich zufrieden mit dem Ergebnis, obwohl 44% Probleme mit der Nahrungsaufnahme zu Protokoll gaben (FOX et al. 1997). Tumoren des periorbitalen Bereichs können per Orbiektomie entfernt werden (O’BRIEN et al. 1996). Rippentumoren können durch die Entfernung einer Brustwand reseziert werden, wobei große Defekte mit einem Polypropylennetz, seltener mit Kunststoffplatten, und kleinere Defekte mit der Muskellappentechnik rekonstruiert werden (MATTHIESEN et al. 1992; PIRKEY-EHRHART et al. 1995; ALLEN et al. 1998). Ein Heranziehen des Zwerchfells kann genutzt werden, um kaudale Defekte zu beheben (PIRKEYEHRHART et al. 1995). Tumoren der Wirbelsäule sind am schlechtesten zu behandeln. Komplette Wirbelentfernungen wie sie in der Humanmedizin beschrieben werden, haben sich in der Veterinärmedizin noch nicht durchgesetzt. Chirurgische Eingriffe werden in der Regel nur zur Diagnosestellung oder zur Dekompression aufgrund neurologischer Defizite durchgeführt (DERNELL et al. 2000). In diesem Zusammenhang sollte ein chirurgischer Eingriff nur zur Dekompression mit oder ohne Stabilisierung durchgeführt werden und anschließend eine Chemo- und Strahlentherapie appliziert werden.
4.2.1.2.3. LOKALISATION WEICHTEILE
In einigen Fallberichten wird die Entfernung von Osteosarkomen des harten Gaumens beschrieben. Nach vollständiger Exzision des
Tumors unter Einhaltung klarer Sicherheitsabstände wird die Wunde durch bilaterale Transposition der Lippenschleimhaut geschlossen. Es konnte eine gute Funktionalität und Lebensqualität mit einer
Überlebenszeit von 14 Monaten erzielt werden (BECK und STRIZEK 1999; BANKS und STRAW 2004).
4.2.2. NICHTOPERATIVE THERAPIEVERFAHREN - ADJUVANTE THERAPIE
Damit die Möglichkeit einer lokalen Rezidivierung von vornherein weitestgehend ausgeschlossen werden kann, muss eine vollständige Resektion des betroffenen Areals erreicht werden. Daher erscheint es sinnvoll, das Tumorgewebe präoperativ und ebenso intraoperativ abzugrenzen. Dieser Ansatz ist vor allem beim LimbSparing Eingriff wichtig, da hierbei bedingt durch die eingeschränkte Radikalität des Eingriffes die Gefahr einer lokalen Rezidivierung im Vergleich zur Amputation ungleich höher ist. Aufgrund der aggressiven Potenz des Osteosarkoms ist daher ein adjuvantes Vorgehen für beide Therapieverfahren zur Aufrechterhaltung einer kurativen Behandlung generell angezeigt (STRAW et al. 1991; THOMPSON et al. 1992; O’BRIEN et al. 1993; WITHROW et al. 1998; BERG et al. 1996; WITHROW 1998).
Mit der adjuvanten Therapie will man vor allem eine Verbesserung der lokalen Kontrolle und der Resektionsränder erzielen. In der reaktiven Zone sollen Satellitenmetastasen erfasst und mit Hilfe lokaler und systemischer Adjuvantien auf chemischer oder physikalischer Basis eine Nekrose der Tumorzellen herbeigeführt werden. In Kombination mit einem chirurgischen Eingriff sollen so die hohen Lokalrezidivraten gesenkt und große Resektionen vermieden werden sowie benachbarte Gelenkfunktionen erhalten bleiben (MAULDIN et al. 1988; POWERS et al. 1991; WITHROW 1998).
Adjuvante Verfahren werden vor allem lokal während des chirurgischen Eingriffes angewendet, während der Einsatz der
Chemotherapie lokal sowie auch systemisch mit dem Vorteil der gleichzeitigen Fernmetastasenbekämpfung Einsatz findet (BERG et al. 1997). Eine Sonderform stellt die sogenannte neoadjuvante
Therapie dar. Sie findet ihren Einsatz präoperativ mit dem Ziel, den Tumor im Vorfeld zu verkleinern und abzugrenzen (Downstaging) (BIELING et al. 1991). Die lokalen Verfahren finden vorwiegend
in der ergänzenden Behandlung von gutartigen Tumoren Gebrauch, sind jedoch ebenso bei der Behandlung von bösartigen Knochentumoren von großem Nutzen.
Die adjuvante Therapie ist vor allem dann sinnvoll, wenn der Tumor sich an einer ungünstigen Lokalisation befindet oder der Defekt
schlecht abgegrenzt ist (v.a. nach neoadjuvantem Downstaging) und damit die Gefahr besteht die Resektionsränder nicht weit genug ansetzen zu können.
Im Folgenden werden die häufigsten eingesetzten Adjuvantien vorgestellt:
4.2.2.1. ADJUVANTE THERAPIEANSÄTZE
4.2.2.1.1. KRYOTHERAPIE
Durch den Einsatz der Kryotherapie werden intrazytoplasmatische Eiskristalle in einer Randumgebung von 0,2 – 1,5 mm erzeugt, was zu einem Zelltod möglicher Tumorzellen in diesem Areal führt. In das Kavum des ehemaligen Tumors wird flüssiger Stickstoff oder über eine Sonde gefrorenes Gel eingebracht. Die Kryotherapie wird in der Humanmedizin bereits für Stadium IA-Sarkome verwendet (MARCOVE et al. 1969). Die Rezidivrate liegt nach MALAWER (1999) bei etwa 8%. Die Anwendung in schwierigen anatomischen Regionen wie dem Sakrum hat sie sich ebenfalls bewährt (KOLLENDER 2003). Neben der Senkung der Rezidivrate liegen die Vorteile der Kryotherapie in der Schonung angrenzender Gelenke und einer Minimalisierung der Blutverluste. Eine typische Spätkomplikation scheint die Fraktur im nekrotischen Bereich des Knochens zu sein. Die Frakturrate liegt bei 11–28 % und die Wundinfektionsrate bei 5–10 %.
4.2.2.1.2. PMMA-ZEMENTIERUNG
Die Polymethylmethacrylat-Zementierung kann ebenso zum Ausfüllen von Kavitäten verwendet werden. Der Zement produziert beim Aushärten eine Temperatur von ca. 90º C. Es wird eine Koagulationsnekrose im Bereich von ca. 1,5 cm erzeugt und zusätzlich die Kavität stabilisiert (PERSSON 1976; MALAWER 1991). Diese Technik führt zu einer sofortigen Stabilität des rekonstruierten Defektes, kann damit in Gelenknähe eingesetzt werden und senkt das Risiko einer pathologischen Fraktur während der Heilung.
75%iges Phenol sterilisiert die Gewebeoberfläche nach einer Kürettage (CAPANNA 1985), ist aber aufgrund des zu geringeren Tiefeneffektes für die Tumorlokalkontrolle ungeeignet (MARCOVE 1982). Spülungen mit einer 50%igen wässrigen ZinkChloridlösung als Adjuvans vor einer Spongiosaplastik führen zu einer Rezidivrate von 13% (ZHEN 2004).
4.2.2.1.4. NEOADJUVANTE KOMBINIERTE RADIO- UND CHEMOTHERAPIE
Der Einsatz adjuvanter und neoadjuvanter Behandlungstechniken wird in der Humanmedizin nach festen Behandlungsprotokollen (COSS beim Osteosarkom, EICESS beim Ewing-Sarkom) umgesetzt.
4.2.2.1.3. EINE AUSWAHL WEITERER VERFAHREN
Mit einer CO2-Laserausbrennung der Tumorränder in Anschluss an eine Kürettage kann man die Tiefe der zu setzenden Nekrose präzise
kontrollieren, was vor allem in Gelenkknorpelnähe von Bedeutung ist (KIRBY 1990). Als Infektionsprophylaxe und zur Beseitigung von Zelltrümmern kann die Jet-Lavage mit gepulstem Wasserstrahl
eingesetzt werden. Eine Tumorlokaltherapie kann damit nicht erreicht werden.
Dort konnte aufgezeigt werden, dass die neoadjuvante Therapie bei hochgradig bösartigen Knochentumoren zu einer Dickenproliferation der Pseudokapsel, einer Verkleinerung der Tumormasse und einer Beseitigung von Skip- und Satellitenabsiedlungen sowie Fernmetastasen führt. Das Downstaging führt deshalb zu einer besseren Abgrenzung des Defekts. Dadurch wird der chirurgische Eingriff erleichtert und eine verbesserte Prognose ist zu erwarten.
Zum gleichen Resultat kamen diverse Studien in der Veterinärmedizin. In zwei Studien bekamen Hunde intraarteriell oder intravenös Cisplatin, eine Strahlentherapie (mittlere Dosis 30Gy, 10 Fraktionen) oder eine Mischung beider Therapien (O’BRIEN et al. 1993; WITHROW et al. 1993).
Die Hunde, die präoperativ über 21 Tage bis 21 Tage vor der Operation intraarteriell Cisplatin erhielten, zeigten einen abgegrenzten
Rückgang der Vaskularisierung des Tumorgewebes. Dieses zeigte sich in einem hohen Grad von induzierter Tumornekrose in den resezierten Gewebeproben, vor allem bei den Patienten, die zusätzlich
einer Strahlentherapie unterzogen wurden. Die Nekroserate steht mit der lokalen Kontrolle des Tumorprozesses in Korrelation. Örtlich konnte man die Erkrankung bei 91% der Tiere mit >90% MNR,
bei 78% der Tiere mit 80–89% MNR und nur bei 30% der Tiere mit <79 MNR unter Kontrolle bringen. Beide Methoden, sowohl die zusätzliche präoperative als auch die intraoperative Behandlung,
führen zu einer deutlich geringeren lokalen Rezidivrate verglichen mit Patienten, die keiner zusätzlichen Behandlung unterzogen wurden. Die Kombination aus Bestrahlung und Chemotherapie führte zu
einer deutlich höher ausfallenden Nekroserate (WITHROW 1998).
Die Anwendung der Strahlentherapie als einzige Methode brachte in einer Untersuchung bei 21 Tieren nur unzureichende Ergebnisse, hinsichtlich des Überlebens der Patienten und des Erhaltes der betreffenden Gliedmaße (THRALL et al. 1990). In einer Studie über den intravenösen Einsatz von Doxorubicin erreichte man Nekroseraten zwischen 0 – 87%. Die mittlere Nekroserate betrug 24,9% (BERG et al. 1995). Es bestand ebenfalls eine deutliche Korrelation zwischen der Nekroserate und der postoperativen Überlebensrate. Zum Zeitpunkt des chirurgischen Eingriffes können außerdem örtliche Polymer-Chemotherapeutika eingebracht werden (WITHROW 1998; DERNELL et al. 2001).
In-vitro Versuche einer neueren Studie zeigen, dass der Einsatz von Meloxicam zu einer zeit- und dosisabhängigen Inhibition des zellulären Wachstums der Osteosarkomzellen führt (WOLFESBERGER et al. 2006). Andere in-vitro Versuche über die Auswirkungen von Piroxicam und Meloxicam kommen zu ähnlichen Ergebnissen. Beide Substanzen zeigen eine Hemmung des zellulären Wachstums der Osteosarkomzelllinien (KNOTTENBELT et al. 2006). Es stellt sich jedoch als schwierig heraus, die nötigen Plasmakonzentrationen für diesen Effekt in vivo zu erreichen. Für einen antineoplastischen Einsatz dieser Substanzen müssen noch weitere Untersuchungen folgen. 4.2.2.1.5. CHEMOTHERAPIE
4.2.2.1.5.1. GRUNDSÄTZLICHES ZUR CHEMOTHERAPIE
Dosierung
Bei der Dosierung von Chemotherapeutika gilt es zu beachten, dass diese den niedrigsten therapeutischen Index besitzen (WHITE 1998). Dies bedeutet, dass die benötigte und die toxische Dosis eng beieinander liegen. Außerdem weisen Neoplasien eine spezifische Empfindlichkeit gegenüber einem Chemotherapeutikum auf. Eine Dosierung ist von verschiedenen pharmakologischen Faktoren abhängig: Von der Dosisintensität (Dosis pro Zeiteinheit), der Applikationsform, dem Blutvolumen, der Absorption, der Metabolisierung, der Exkretion und den Wechselwirkungen mit anderen Chemotherapeutika (DEVITA 1997).
Die Dosierung erfolgt anhand der Körperoberfläche, da diese in enger Verbindung mit wichtigen Stoffwechselvorgängen (Blutvolumen,
Harnstoffclearance und
glomeruläre Filtrationsrate) im Körper einhergeht (PINKEL 1958; FRAZIER und PRICE 1998). Die Ermittlung der Körperoberfläche
erfolgt nach der Formel von Meck (NOLTE und NOLTE 2000):


Zellkinetik und Chemotherapieempfindlichkeit
Die Wirkung der Chemotherapeutika entfaltet sich in erster Linie auf sich teilende Tumorzellen (WHITE 1998). Ein Zellzyklus wird in mehrere Phasen unterteilt, die zwischen zwei Mitosen ablaufen (M-, G1-, GO-, S-, G2- Phase). Man unterscheidet zwischen phasen- und zellzyklusabhängige sowie zellzyklusunabhängige Chemotherapeutika. Phasenabhängige Chemotherapeutika schädigen Zellen nur in bestimmten Phasen, während zellzyklusabhängige Chemotherapeutika Zellen in mehreren Phasen schädigen. Zellzyklusunabhängige Chemotherapeutika erfassen auch ruhende Zellen („dormant cancer cells“). Da das Osteosarkom langsam wächst, erscheint es sinnvoll hier vor allem Zytostatika einzusetzen, die zellzyklusunabhängig greifen.
Das Wachstum von Neoplasien erfolgt nach der Gompertzianischen Wachstumskinetik, das bedeutet das ein Tumor zunächst
pseudoexponentiell wächst, sich dann jedoch die Wachstumsgeschwindigkeit verlangsamt, bis ein Gleichgewichtszustand („steady state“) erreicht wird (DEVITA 1997). Im Inneren des Tumors kommt es zu
einer Verlängerung der Teilungszeit bis hin zum Absterben der Zellen. Ursächlich könnten ischämische Zustände sein. In jedem Fall verringert sich die Wachstumsfraktion. Je kleiner also ein Tumor,
desto höher ist seine Empfindlichkeit gegenüber einer Chemotherapie und je höher die Dosis, desto mehr Tumorzellen werden abgetötet. Daher gilt für eine Chemotherapie, je früher ein Tumor mit der
höchsten tolerablen Dosis behandelt wird, desto günstiger gestalten sich Prognose und Auskommen.
Die Dosis und das Dosisintervall können im Laufe der Therapie variieren, man unterscheidet drei Phasen in der Chemotherapie
(DEVITA 1997):

Chemotherapieresistenz
Die Chemotherapieresistenz ist das schwierigste Problem einer Chemotherapie. Normale Zellen werden niemals resistent. Es werden
drei Formen der Resistenzen unterschieden (ROBERT 1999):

Therapieformen
- Primärtherapie
Die Therapie dient der Zerstörung des Tumorgewebes.
- Kombinationschemotherapie
Monotherapien haben sich nicht bewährt, sinnvolle Kombination können gefahren werden (OGILVIE et al. 1993; BLAKE et al. 1999; CHUN et al. 2000; KENT et al. 2004, CHUN et al. 2005). Durch verschiedene Ansatzpunkte unterschiedlicher Chemotherapeutika wird eine höhere Zerstörungsrate des Tumorgewebes erreicht (WHITE 1998). Schwere Nebenwirkungen werden durch unterschiedliche Toxizitäten insgesamt reduziert. Die Gefahr der Resistenz ist geringer, da die Wahrscheinlichkeit höher ist unterschiedliche maligne Klone zu erfassen (ROBERT 1999).
- Adjuvante Therapie
Nach einem chirurgischen Eingriff oder einer Strahlentherapie wird die Therapie mit dem Ziel durchgeführt, residuale Tumorzellen bzw. klinisch nicht fassbare Mikrometastasen zu zerstören (MAULDIN et al. 1988; POWERS et al. 1991; STRAW et al. 1991; THOMPSON et al. 1992; O’BRIEN et al. 1993; WITHROW et al. 1993; BERG et al. 1995; WITHROW 1998).
- Neoadjuvante Chemotherapie
Die Therapie wird vor einem chirurgischen Eingriff oder einer Bestrahlung mit dem Ziel durchgeführt, die Tumormasse zu verringern oder einer Metastasierung vorzubeugen (BIELING et al. 1999).
Effektivität des Erfolges einer Chemotherapie
Das Maß für die Effektivität eines Chemotherapeutikums wird anhand der Nekroserate in Prozent erhoben. Als Grundlage dient das
Gewebematerial, das bei der Operation gewonnen wird. Eine Erfassung ist natürlich nur dann möglich, wenn mit der Chemotherapie vor dem chirurgischen Eingriff begonnen wurde (neoadjuvante
Chemotherapie).
In der Humanmedizin ist diese Art von Bestimmung ein wichtiges Indiz, um den Erfolg bzw. die Effektivität einer präoperativen Behandlung zu beurteilen (CHUANG et al. 1981; JAFFE et al. 1983; AYALA et al. 1984; BACCI et al. 1987; SHAPIRO et al. 1988; WINKLER et al. 1988).
Demnach ist eine präoperative Behandlung mit einer niedrigen Nekroserate als nicht erfolgreich oder als unzureichend zu bezeichnen, dementsprechend muss der postoperative Behandlungsplan geändert werden (ROSEN 1982).
Der große Vorteil einer präoperativen Behandlung liegt neben der frühzeitigen Bekämpfung möglicher Metastasen vor allem darin, dass
durch eine gezielte Tumorzellnekrosenbildung genügend Raum für eine möglichst vollständige Resektion des Tumorgewebes geschaffen wird. In der Veterinärmedizin wurde die mittlere Nekroserate
verschiedener präoperativer Behandlungen beim Hund beurteilt (POWERS et al. 1996). Man kam zu folgenden Ergebnissen:
Unbehandelte Tumoren: n=94, 27% MNR
Bestrahlung alleine: n=23, 82% MNR
2 Dosen i. a. Cisplatin, 70mg/m2/Dosis n=14, 45%
2 Dosen i. v. Cisplatin, 70mg/m2/Dosis n=6, 24%
2 Dosen i. a. Cisplatin, 70mg/m2/Dosis + Bestrahlung n=45,82%
10 Dosen i. v. Cisplatin, 10mg/m2/Dosis + Bestrahlung n=8, 78%
Nebenwirkungen/Toxizität
Die Chemotherapie nutzt den Umstand aus, dass sich in neoplastischem Gewebe wesentlich mehr Zellen in der Wachstumsphase befinden als im Normalgewebe (DEVITA 1997). Eine tumorspezifische Behandlung ist nicht möglich, da der Unterschied zwischen der Tumorzelle und der Normalzelle nicht qualitativ, sondern lediglich quantitativer Natur ist. Damit werden durch eine Chemotherapie zwangsläufig Normalzellen in Mitleidenschaft gezogen.
Es muss also versucht werden ein Präparat und eine Dosis einzusetzen, die möglichst viele Tumorzellen, aber möglichst wenige Normalzellen erfasst (VRIESENDORP et al. 1987; WHITE 1998).
Die maximale tolerierbare Dosis und die maximale kumulative Dosis dürfen nicht überschritten werden, obwohl die besten Behandlungserfolge mit Dosen im „Grenzbereich“ erzielt werden.
Die Stärke der Nebenwirkungen hängt von der Art, der Dosis, dem zeitlichen Intervall und von den patientenspezifischen Faktoren
wie z.B. dem Allgemeinbefinden ab. Vor allem sich schnell teilende Zellen werden geschädigt, neben neoplastischen Zellen also auch normale Zellen, davon sind vor allem die in der Tabelle 21
dargestellten Gewebe betroffen (VRIESENDORP et al. 1987; DEVITA 1997; WHITE 1998).

Knochenmark
Eine Myelosuppression ist die häufigste dosislimiterende Komplikation bei der Anwendung von Chemotherapeutika (VRIESENDORP et
al. 1987). Eine schwere Granulozytopenie wird häufiger beobachtet, schwere Anämien und Thrombozytopenien sind seltener. Das weiße Blutbild muss zur Infektionsprophylaxe sorgfältig kontrolliert
und beobachtet werden.

Eine neuere Studie, die sich mit dem Effekt der Chemotherapie auf das Immunsystem befasst, kommt zu dem Ergebnis, dass die Immunsuppression deutlich geringer ausfällt als ursprünglich angenommen (WALTER et al. 2006). Es muss jedoch beachtet werden, dass in dieser Studie überwiegend Tiere am Osteosarkom erkrankt waren, die bereits vor der Behandlung stark erniedrigte TZellwerte aufwiesen.
Magen-Darmtrakt
Cisplatin führt bereits nach 1–6 Stunden zu starkem Brechreiz. Der Einsatz von Metoclopramid kann diesbezüglich Abhilfe
schaffen (BERG 1996; CHUN et al. 2005).

Allergische Reaktionen
Gerade der Einsatz von Cisplatin und Doxorubicin kann zu einem anaphylaktischen Schock führen (HAHN et al. 1997; CHUN et al. 2005). Um diesen Umstand zu umgehen ist es sinnvoll, vor der Applikation dieser Medikamente intravenösKortikosteroide (z.B. 2mg/kg Dexamethason) oder Antihistaminika (z.B. Benadryl) zu verabreichen. Außerdem kann durch eine versehentliche paravaskuläre Applikation von Doxorubicin eine schwere lokale Irritation auftreten. Die Infusion muss sofort abgebrochen werden, durch Infiltration von Heparinlösung wird das Medikament ausgefällt, kalte Umschläge lindern die Entzündung, Nekrosen müssen unter Umständen chirurgisch entfernt werden.
Um eine sichere Verabreichung vor allem von Platinum-Arzneimitteln zu gewährleisten, muss sichergestellt werden, dass der Patient mehr als 3000 polymorphkernige Leukozyten/μl und mehr als 150 000
Thrombozyten/μl, einen normalen BUN- und Kreatininwert und ein spezifisches Gewicht des Urins von 1030 ohne Proteinurie und Harnzylindern im Sediment hat (STRAW et al. 1991).
Notwendigkeit und Zeitpunkt einer chemotherapeutischen Behandlung Um eine sinnvolle Bekämpfung der Metastasen und eine Verhinderung von Rezidiven zu erreichen, ist es unumgänglich begleitend zum chirurgischen Eingriff eine Chemotherapie durchzuführen (STRAW et al. 1991; THOMPSON et al. 1992; O’BRIEN et al. 1993; WITHROW et al. 1998; BERG et al. 1996; WITHROW 1998). Wie bereits beschrieben führten Behandlungsversuche, die einzig und allein aus einem chirurgischen Eingriff bestanden, innerhalb weniger Monate zu einem baldigen Tod der Patienten aufgrund von Rezidivbildungen (BRODERY et al. 1969; MADEWELL et al. 1978; SHAPIRO et al. 1988; SPODNICK et al. 1992; WITHROW 1996; ZACHOS et al. 1999).
Studien über den Einsatz von Chemotherapeutika als zusätzliche Behandlung zum chirurgischen Eingriff zeigen, dass sich durch
deren Anwendung eine deutlich verbesserte Überlebensrate erzielen lässt.

Die mittlere Überlebenszeit nach einer Lungenmetastasektomie beträgt 5–6 Monate (STRAW et al. 1991). Natürlich muss versucht werden, so früh wie möglich mit der Applikation eines Chemotherapeutikums zu beginnen. Am besten schon vor dem Zeitpunkt des Eingriffes. In einem Bericht wurden 36 Tiere, die an einem Osteosarkom der Gliedmaßen erkrankt waren, mit Amputation und Cisplatin behandelt (STRAW et al. 1991). Zwei Gruppen wurden zusammengestellt, beide erfuhren zwei Therapiesitzungen im Abstand von 21 Tagen mit 70mg/m2 Cisplatin. Gruppe 1 (17 Tiere) erhielt vorwiegend am 18.ten Tag nach der Operation die erste Dosis. Gruppe 2 (19 Tiere) erhielt intravenös die erste Dosis zum Zeitpunkt der Diagnose. Als Kontrollgruppe dienten 35 Tiere, die lediglich einer Amputation unterzogen wurden.
Gruppe 1 erzielte eine mittlere Überlebenszeit von 262 Tagen, 38% der Tiere überlebten 1 Jahr und 18% der Tiere 2 Jahre. Gruppe 2
erzielte eine mittlere Überlebenszeit von 282 Tagen, 43% der Tiere überlebten 1 Jahr und 16% der Tiere 2 Jahre. Die Kontrollgruppe erzielte eine mittlere Überlebenszeit von 119 Tagen, mit 11 %
Überlebenden nach einem Jahr und 4 % Überlebenden nach 2 Jahren. Sowohl in verschiedenen klinischen Studien der Humanmedizin (ROSEN 1982; REMAGEN et al. 1983; ROESSNER et al. 1983; WINKLER et al.
1984; ROSEN 1986; KALIFA et al. 1995) als auch bei Tierversuchen an Nagern (BELL et al. 1988; FISHER et al. 1989) verdichten sich die Beweise auf Erfolge der präoperativen Chemotherapie beim
Osteosarkom.
Die hohe Wirksamkeit der neoadjuvanten Chemotherapie ist sicher nachgewiesen und hat zu einer entscheidenden Verbesserung der Behandlungsergebnisse, von ca. 20% auf 70% bei einer Fünf-Jahres-Überlebensrate, geführt (BIELING et al. 1991). Um eine schnellere Erholung des Patienten und eine schnellere Wundheilung nach der operativen Entfernung des Primärtumors zu erzielen, wird der Beginn der chemotherapeutischen Behandlung oftmals um 2 – 4 Wochen verschoben.
In einer klinischen Studie hierzu wurden 102 am Osteosarkom erkrankte Hunde mit einer Amputation und einer Kombinationstherapie aus Doxorubicin und Cisplatin behandelt (BERG et al. 1997). Zwei Gruppen wurden gebildet: Bei Gruppe 1 wurde am 2.ten Tag und bei Gruppe 2 am 10.ten Tag nach dem chirurgischen Eingriff mit der Chemotherapie begonnen. Die mittlere Überlebenszeit von Gruppe 1 betrug 11,5 Monate, die von Gruppe 2 11 Monate. Die mittlere Überlebenszeit einer Vergleichsgruppe mit 162 Hunden, die nur einer Amputation unterzogen wurden, betrug 5,5 Monate.
Eine neuere Studie über den kombinierten Einsatz von Doxorubicin und Cisplatin rät davon ab, bereits am 2. Tag in den empfohlenen Dosen mit der Chemotherapie zu beginnen (DEREGIS et al. 2003)
Die toxischen Effekte sind zu diesem Zeitpunkt zu stark. Es wird eine zeitliche Aufschiebung der Behandlung und eine Senkung der
Doxorubicin Dosis auf 12,5- 20mg/ m2 empfohlen, wenn diese in Kombination mit einer Cisplatin Dosis von 60mg/m2 verabreicht werden soll. 4.2.2.1.5.2. CISPLATIN Cisplatin ist ein platinhaltiger
Schwermetallkomplex mit einer zellzyklusunabhängigen Wirkung (O’DWYER et al. 1997). In Flüssigkeiten mit einem hohen Chloridionenanteil wie die der physiologischen Kochsalzlösung und auch im
extrazellulären Raum bleibt es ungebunden, während es sich in Flüssigkeiten mit niedrigem Chloridionenanteil, also intrazellulär, in eine positiv geladene Form umwandelt, die DNA-Nukleotide
bindet. Resistenzen sind möglich durch zellaktivierte DNA-Reparaturmechanismen. Cisplatin führt zu zahlreichen Nebenwirkungen. Am gefährlichsten ist hierbei die Nierenschädigung, die auf einer
Akkumulation in den Tubuli mit anschließender Nekrose beruht. Zudem aktiviert Cisplatin das Renin-Angiotensin-System, senkt damit die glomeruläre Filtrationsrate und setzt den renalen Blutfluss
herab, was eine Tubulusnekrose zusätzlich begünstigt (STRAW et al. 1991; CHUN et al. 2005).
Prophylaktisch sollen eine Mannitdiurese und eine Infusionen mit physiologischer Kochsalzlösung helfen. Therapiebegleitend müssen die Nierenparameter überwacht werden und Harnanalysen durchgeführt werden.
Cisplatin führt zu einer verbesserten Lebenserwartung bei Hunden, die einer Amputation unterzogen wurden (MAULDIN et al. 1988; SHAPIRO et al. 1988). Die erforderliche Dosis für Cisplatin liegt bei 50-70 mg/m2. Eine ansteigende kumulative Dosis von Cisplatin scheint die Überlebenswahrscheinlichkeit der Patienten zu steigern (THOMPSON und FUGENT 1992; DERNELL et al. 1993; O’BRIEN et al. 1993). In einer Studie wurden nach einer Amputation oder einem Limb-Sparing Eingriff 2–6 Dosen Cisplatin im Abstand von 21 Tagen (70 mg/m2) an 200 Hunde verabreicht. Einige der Hunde erhielten zusätzlich eine örtliche Chemotherapie mit Cisplatin. Die mittlere Überlebenszeit lag zwischen 242 und 392 Tagen und die einjährige Überlebensrate zwischen 41– 65%. Die einjährige Überlebenszeit war abhängig von der Anzahl der Dosen, die verabreicht wurden (DERNELL et al. 1993).
Hinsichtlich der Überlebenszeit konnte zwischen einer intravenösen oder intraarteriellen Verabreichung des Cisplatins kein
statistischer Unterschied gefunden werden (LARUE et al. 1989).
In Tabelle 25 sind verschiedene Studien und Therapieprotokolle zum Einsatz von Cisplatin zusammengefasst.
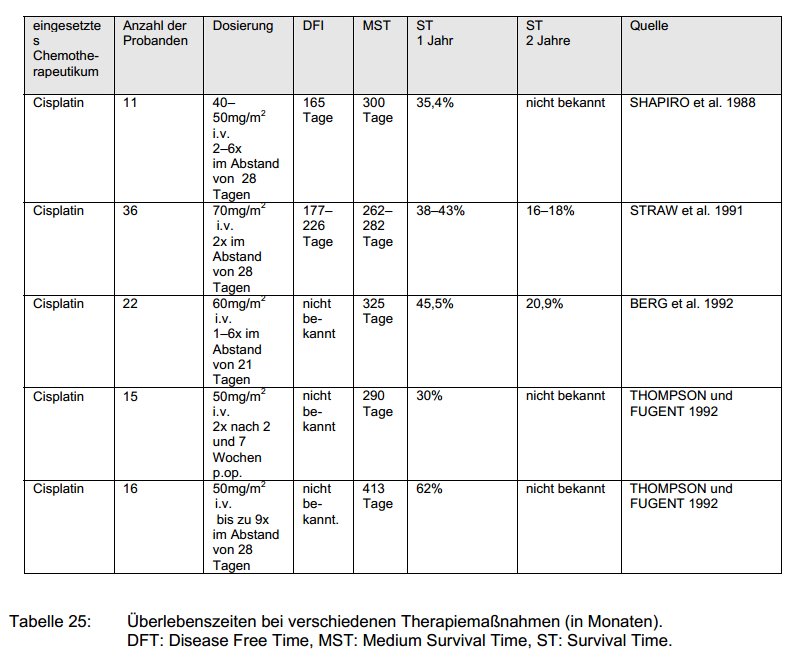
In einer Studie wurden sogar 90 mg/m2 verabreicht, ohne dass dieses zumindest auf kurze Sicht zu einer Nephrotoxikose führte (FALLIN
und FORRESTER 1994). Trotzdem verhält es sich so, dass mit steigender Dosis von Cisplatin die gastrointestinale Toxikose, die Suppression des Knochenmarkes, die Nephrotoxizität und damit
lebensbedrohende Komplikationen stark zunehmen. Die Nephrotoxizität ist der hauptsächliche dosislimitierende Faktor. Man kann diesen Umstand über eine erhöhte Salzdiurese wirksam bekämpfen
(OGILVIE et al. 1988). In der Humanmedizin zeigte der Einsatz von Amifostine, dass es die Toxizität herabsetzt, die durch erhöhte Dosen Cisplatin oder durch hohe Dosen anderer Platinum-Präparate
erzeugt wird (CAPIZZI 1999).
Über den Einsatz bei Hunden wird hierzu bis jetzt wenig beschrieben. Amifostine wurde zusammen mit Cisplatin bei einer geringen Anzahl von Hunden bis zu einer Dosis von 100 mg/m2 zusammen mit einer Diurese verabreicht (DERNELL 2001).
4.2.2.1.5.3. CARBOPLATIN
Carboplatin ist eine Platinumverbindung der zweiten Generation. Es hat einen geringeren nephrotoxischen Effekt, aber nahezu die
gleichen tumorschädigenden Eigenschaften wie Cisplatin (CURT et al. 1983; CALVERT et al. 1985; KOELLER et al. 1986; CANETTA et al. 1987 und 1988). In Tabelle 26 sind verschiedene Studien und ein
Therapieprotokoll zum Einsatz von Carboplatin zusammengefasst.

Carboplatin ist ein gut verträgliches Chemotherapeutikum, das sicher in einer Dosis von 300 mg/m2 auf vier Gaben verteilt und im Abstand von 3 Wochen appliziert werden kann. Die auftretende Neutropenie wird als Dosis limitierend beschrieben (BERGMAN et al. 1996). Eine maximale kumulative Dosis wurde noch nicht beschrieben (DERNELL et al. 2001). Trotzdem zeigen jüngere Studien mit der gleichen Dosis keine derartigen Überle-benszeiten (KHANNA et al. 2000). Einer der Vorteile von Carboplatin ist, dass es ohne zusätzliche Salzdiurese angewendet werden kann wie sie bei Cisplatin notwendig wird (CURT et al. 1983; CALVERT et al. 1985; KOELLER et al. 1986; CANETTA et al. 1987 und 1988). Es kann zum Zeitpunkt der Amputation und danach alle 21 Tage verabreicht werden, vorausgesetzt es kommt zu keiner schwereren Knochenmarkssuppression.
4.2.2.1.5.4. LOBOPLATIN
Loboplatin ist ein Platinum-Arzneimittel der dritten Generation. Tabelle 27 beschreibt ein Therapieprotokoll zum Einsatz von
Lobaplatin.

Es bleibt jedoch erforderlich, dass weitere Untersuchungen bezüglich des Verhaltens von Carbo- und Loboplatin am Osteosarkom des Hundes durchgeführt werden, um deren Effizienz bewerten zu können.
4.2.2.1.5.5. DOXORUBICIN
Doxorubicin ist ein natürlich vorkommendes Produkt eines Edelpilzes und zählt zu der Gruppe der „antitumorösen“ Antibiotika. Es wirkt zellzyklusunabhängig und bindet an DNA- und RNA-Stränge unter Bildung stabiler Komplexe (STEWART und RATAIN 1997).
Beim Hund ist vor allem die Kardiotoxizität des Präparats als dosislimitierend zu bezeichnen (MAULDIN et al. 1992).
Eine Gesamtdosis von 200mg/m2 sollte nicht überschritten werden. In Tabelle 28 sind verschiedene Studien und Therapieprotokolle
zum Einsatz von Doxorubicin zusammengefasst.
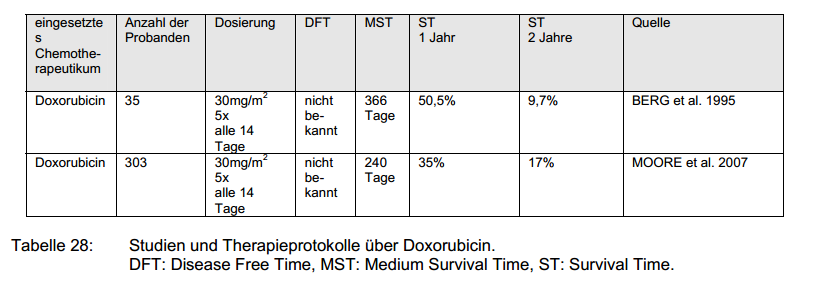
In einem Bericht über 16 Hunde erweist sich Doxorubicin als Monochemotherapie mit nur schwacher Antwort (MADEWELL et al. 1978). Hier wurde Doxorubicin intravenös in einer Dosis von 30mg/m2 alle 3 Wochen verabreicht. Begonnen wurde 3 Wochen nach der Amputation.
In einer anderen Studie wurde Doxorubicin in derselben Dosis alle 2 Wochen 5-mal 35 Hunden mit einem Osteosarkom der Gliedmaße verabreicht (BERG et al. 1995). Der chirurgische Eingriff erfolgte entweder 13 Tage nach der zweiten oder der dritten Applikation, mit einer anschließenden Gabe am Tag nach der OP. Die 1- bzw. 2- jährige Überlebensrate lag bei 50,5 bzw. 9,7%. Es konnte kein Unterschied ermittelt werden zwischen Tieren, die vor oder kurz nach der OP behandelt wurden. Warum die 2-jährige Überlebensrate schlechter als bei Cisplatin ausfiel, konnte nicht beantwortet werden.
Eine aktuelle Studie mit 303 Hunden über die Amputation und Doxorubicinbehandlung konnte die bereits erzielten Ergebnisse bestätigen (MOORE et al. 2007). Die zusätzliche Erprobung von BAY 12-9566 führte zu keiner Verbesserung der Überlebensrate.
4.2.2.1.5.6. KOMBINATION VERSCHIEDENER PRÄPARATE
Es gibt verschiedene Berichte über den Einsatz kombinierter Chemotherapeutika. Da die einzelnen Präparate bereits eine gewisse
Potenz bezüglich der Verbesserung der Überlebensrate bewiesen haben, scheint es sinnvoll Cisplatin mit Carboplatin oder Doxorubicin zu kombinieren.
In Tabelle 29 sind verschiedene Studien und Therapieprotokolle zusammengefasst, in denen verschiedene Chemotherapeutika
kombiniert angewendet wurden.

Eine Studie erprobte den Einsatz von Cisplatin mit Doxorubicin (CHUN et al. 2000). Cisplatin wurde am Tag des Eingriffes in einer Dosis von 50mg/m2 verabreicht, am Tag darauf Doxorubicin in einer Dosis von 10mg/m2. Die Toxizität blieb im Toleranzbereich und die 16 Hunde erreichten eine mittlere Überlebenszeit von 18 Monaten. In einer größeren Studie wurde Doxorubicin mit 15–20mg/m2 und 2 Stunden später Cisplatin in einer Dosis von 60mg/m2 verabreicht (BERG et al. 1997). Die Toxizität blieb ähnlich tolerierbar. Die mittlere Überlebenszeit der 102 Hunde betrug etwas mehr als 11 Monate.
In einer weiteren Studie wurde die Anwendung von Cisplatin mit Doxorubicin und Carboplatin mit Doxorubicin verglichen (BLAKE et al.
1999). Die erste Gruppe erzielte eine mittlere Überlebenszeit von 449 Tagen, die zweite Gruppe eine mittlere Überlebenszeit von 202 Tagen.
4.2.2.1.5.7. EINSATZ VON ARZNEISTOFFEN IN AUSGEWÄHLTEN POLYMEREN
Ein Verabreichungssystem (Drug Delivery Technology) wurde entwickelt, um über ein Medium von ausgewählten Polymeren hohe
Konzentrationen von Chemotherapeutika lokal in eine chirurgische Wunde verbringen zu können, wobei dann geringe Dosen des Präparates mit systemischer Wirkung freigesetzt werden können (KURZMAN et
al. 1995). Das System besteht aus einem biologisch optimal abbaubarem Polymer, dem open-cell polyactic acid (OPLA), das Cisplatin enthält (OPLA-Pt). Wird OPLA-Pt bei gesunden Tieren in eine Wunde
implantiert, führt es weder zu systemischer Toxizität noch zu einer Beschädigung des kortikalen Transplantates, obwohl Dosen bis zu 80 mg/m2 Cisplatin eingesetzt werden (STRAW et al. 1994). Die
Auswertung von pharmakologischen Daten aus Serumproben zeigte einen 30fachen Anstieg in der AUC (Area under the curve) für die systemische Platinum-freisetzung im Vergleich zu der intravenösen
Gabe einer einzigen Dosis Cisplatin. Die Konzentrationen in der lokalen Wunde betrugen das 50-fache einer einfachen intravenösen Dosis Cisplatin.
Dieses Verabreichungssystem zeigt vor allem im Zusammenhang mit einem LimbSparing Eingriff eine Potenz in der Kontrolle der lokalen
Tumorrekurrenz. Als einzige Behandlungsform hat es sich dort nicht bewährt (WITHROW et al. 1996). Theoretisch wird dieser Effekt den hohen Dosen Cisplatins zugeschrieben, die über das Implantat
dem Tumorbett zugeführt und dort freigesetzt werden, insbesondere wenn die Entfernung des Tumors mikroskopisch inkomplett war.
Ebenso scheint eine bessere Kontrolle entfernter mikroskopischer Tumoren möglich zu werden, da Cisplatin aus dem Implantat gezielt
in Raten freigesetzt wird und über eine längere Periode von etwa 3–4 Wochen (slow release) über die Zirkulation wirken kann. 39 Tiere des Stadiums IIB wurden amputiert und mit einer Dosis OPLAPt
86 mg/m2, die in das Muskelgewebe des amputierten Stumpfes implantiert wurde, behandelt (WITHROW et al. 1995). Die mittlere Überlebenszeit lag bei 240 Tagen und die einjährige Überlebensrate lag
bei 41,2%. Das entspricht in etwa dem Zugewinn in der Überlebenswahrscheinlichkeit, als wenn man 2 Dosen Cisplatin intravenös zusätzlich zu einer Amputation appliziert hätte. Wenn bei dieser
Gruppe von Tieren der Effekt der AUC auf das Überleben bewertet wird, dann hätte eine AUC von mehr als 7μg/ml/min eine signifikant längere Überlebenszeit als die unter 7μg/ml/min.
Dieser Umstand unterstützt die Notwendigkeit das „sustained-release drug delivery system“ bei der zusätzlichen Behandlung des
Osteosarkoms in Betracht zu ziehen. Momentan wird der Effekt mehrfach wiederholter Gaben von OPLA-Pt zur Kontrolle von mikrometastatischen Tumoren im caninen Osteosarkom-Modell untersucht
(DERNELL et al. 2001). Die lokale Gewebetoxizität des Systems von etwa 30% wird hierbei noch als Hauptkomplikation angesehen. Eine Knochenmarksuppression lässt sich ab einer Gabe von 100 mg/m2
vorher-sagen (CIEKOT et al. 1992). Es wurde auch ein weiteres System getestet (DERNELL et al. 1998). Es handelt sich um ein injektierbares polylactic acid polymer system (Atrigel) für ein
„sustained release“ von Cisplatin (Atriplat). Pharmakokinetische Studien zeigten eine ähnliche Freisetzungskinetik wie beim OPLA-PT und zwar mit einer vorhersehbaren Knochenmarkssuppression und
-toxizität. Die lokale Toxizität bleibt nach wie vor die Hauptkomplikation dieser Behandlungsmethode.
4.2.2.1.6. RADIOTHERAPIE
Der Einsatz der kurativen Radiotherapie kann vor allem als Möglichkeit genutzt werden, um präoperativ das Tumorgebiet für einen nachfolgenden chirurgischen Eingriff besser abgrenzen zu können.
4.2.2.1.6.1. GRUNDSÄTZLICHES ZUR RADIOTHERAPIE
Die Radiotherapie führt durch Einsatz gezielter ionisierender Strahlung zu einer molekularen Schädigung der Zell-DNA und bewirkt
damit eine Verhinderung der weiteren Zellteilung bzw. führt unmittelbar zum Zelltod (KASER-HOTZ et al. 1994; BURK und GIEL 1997).
Es wird zwischen partikulärer (z.B. Elektronen, Protonen) oder elektromagnetischer (Gamma-, Röntgenstrahlung) Strahlung unterschieden. Letztere findet in der Veterinärmedizin häufiger Anwendung. Die Quasischwellendosis (Dq)ist die erforderliche Dosis, um eine reparable sublethale Schädigung der Zellen zu überschreiten.
Eine sublethale Schädigung kann zur Regeneration des bestrahlten Gewebes und damit zu einer Radioresistenz führen. Die Energieeinheit der ionisierenden Strahlung ist 1 Gray (Gy), was der Energie von 1 J/kg entspricht. Die Radiosensivität beschreibt die Empfindlichkeit einer Zellpopulation gegenüber ionisierender Strahlung. Die Radiosensivität eines Gewebes ist vor allem von seinem Differenzierungsgrad und seiner Zellteilungsrate abhängig. Je geringer ein Gewebe differenziert ist und je höher dessen Zellteilungsrate, desto empfindlicher reagiert es auf die ionisierende Strahlung. Die Radiosensivität von Tumorgewebe leitet sich von der seines Ursprungsgewebes ab.
Das Osteosarkom ist kaum strahlensensibel (MCENTEE 1997). Eine Strahlentherapie ist deshalb nur im Einzelfall bei
Inoperabilität, einem Resttumor (R2- Resektion) und einem palliativen Therapieansatz zu erwägen.

Als mesenchymaler Tumor weist das Osteosarkom eine geringe Strahlensensivität auf (MCENTEE 1997). Deshalb muss ein Osteosarkom mit einer entsprechend hohen Gesamtstrahlungsdosis behandelt werden, was wiederum hinsichtlich der Toxizität entsprechende Auswirkungen auf das umliegende Gewebe hat.
Die Bestrahlung erfolgt daher durch die Gabe von Einzeldosen, sogenannten Fraktionen (MCNIEL und LARUE 1998; BONE TRIAL WORKING PARTY 1999). So kann durch mehrere Sitzungen mit einer moderaten Strahlungsintensität eine Gesamtdosis kumuliert werden.
Auf diese Weise können sich sublethal geschädigte Normalgewebezellen wieder erholen (WHITHERS 1975). Normalgewebe repariert sich schneller als neoplastisches Gewebe. Außerdem kann in den Pausen der Zellzyklus der neoplastischen Zellen fortschreiten, damit können bei der nächsten Sitzung Zellen erfasst werden, die bisher strahlenresistent waren. Zudem kommt es in den Behandlungspausen zu einer Reoxygenierung von hypoxischen Tumorbezirken, wodurch die dortigen Zellen wieder sensibilisiert werden.
Die Zeiträume zwischen den einzelnen Fraktionen dürfen jedoch nicht zu groß gewählt werden, sonst kann es zu einer Repopulation des Tumors kommen. Daher sollten größere Behandlungsunterbrechungen, außer im Falle schwerer toxischer Nebenwirkungen, nicht stattfinden (NOLTE und NOLTE 1999).
Zellen die nicht zerstört werden, teilen sich weiter und zwar schneller als zuvor. Es wird vom Phänom der beschleunigten Repopulation gesprochen (WITHERS et al.1988). Bereits nach einer vierwöchigen Therapie kann eine deutlich schnellere Repopulation beobachtet werden als anfangs.
Eine erfolgreiche Tumorbekämpfung ist abhängig von der Gesamtdosis die das neoplastische Gewebe erhält. Es muss über dem Schwellenwert bestrahlt werden, wobei die Fraktionsdosis jedoch durch die Komplikationsrate, die Strahlentoxizität, limitiert wird (WHITHERS 1975).
Es konnte gezeigt werden, dass mit moderaten Fraktionsdosen insgesamt hohe Gesamtstrahlendosen erreicht werden können, ohne dass
nennenswerte Toxizitätssteigerungen auftreten (COUTARD 1931; WHITHERS 1975; STEENLAND et al. 1982; MCNIEL und LARUE 1998; BONE TRIAL WORKING PARTY 1999). Idealerweise sollten Fraktionsdosen von 2
Gy oder weniger verwendet werden, eine Dosis von 3 Gy soll die obere Grenze sein. Sinnvoll sind drei Sitzungen pro Woche, empfohlen werden jedoch 5 Sitzungen, um die Pausen mit der Gefahr einer
Tumorrepopulation nicht zu groß werden zu lassen (NOLTE und NOLTE 1999).
4.2.2.1.6.2. KURATIVE ANWENDUNG DER RADIOTHERAPIE
Bestrahlungen als Einzeltherapie ohne einen chirurgischen Eingriff, selbst in Kombination mit Einsatz systemischer Chemotherapeutika, konnten laut ZACHOS et al. (1999) beim Osteosarkom keine deutlichen Verbesserungen der Überlebensrate erzielen.
Die Radiotherapie führt in jedem Fall zur Tumornekrose, fibrinöser Organisation, Kalzifikation und Bildung von Knochensubstanz (MATSUBAYASHI et al. 1981). Es ist daher sinnvoll eine kurative Radiotherapie in Kombination mit anderen Therapieverfahren einzusetzen. Sie sollte vor einem chirurgischen Eingriff eingesetzt werden, um vor allem bei Limb-Sparing Eingriffen eine möglichst sinnvolle Abgrenzung des Tumorbezirks zu erreichen und sie sollte genutzt werden, um im Anschluss an den chirurgischen Eingriff zusätzlich zur Chemotherapie die Metastasenbildung zu bekämpfen.
Das zu erreichende Nahziel einer definitiven oder kurativen Radiotherapie liegt damit in der Erlangung einer möglichst guten Tumorkontrolle mit einer entsprechend verlängerten Überlebenschance für den Patienten. Dieses Ziel kann wie bereits beschrieben mit der Radiotherapie alleine nicht verwirklicht werden.
Die Kombination von Radiotherapie und Limb-Sparing wurde bereits beschrieben (THRALL et al. 1990; WITHROW et al. 1993). Durch Bestrahlungen kam es zu einer nachweisbaren Nekrose der Zellen des Primärtumors. 15 Hunde, die einem LimbSparing Eingriff unterzogen wurden, wurden über 10 Fraktionen einer Gesamtstrahlungsdosis von 25 oder 40 Gy ausgesetzt. 8 Hunde erhielten intraarteriell zwei Dosen 70mg/m2 und 7 Hunde erhielten intravenös 10 Dosen 10mg/m2 Cisplatin (LARUE et al. 1989). Hinsichtlich der Überlebenszeit konnte zwischen einer intravenösen oder intraarteriellen Verabreichung des Cisplatins kein statistisch signifikanter Unterschied gefunden werden.
Die PTN betrug 79% und die Tumornekroserate mehr als 80%. In dieser Hinsicht kann die Bestrahlung genutzt werden, um das
Tumorgeschehen auf ein Niveau herabzusetzen, das einen erfolgreicheren chirurgischen Eingriff ermöglicht.
4.2.2.1.6.3. RADIOTHERAPIE: TOXIZITÄT UND VERTRÄGLICHKEIT FÜR DEN PATIENTEN, PROGNOSESTELLUNG
Die Reaktion des Tumors, des gesunden Gewebes und des Patienten auf die radiotherapeutische Behandlung müssen eingehend überwacht werden, um die weitere Behandlung des Patienten dem Therapieerfolg und eventuellen Toxizitätserscheinungen anpassen zu können (OGILVIE et al. 1991; MAULDIN 1997).
Das nachfolgende Schema für Radiotherapiepatienten soll helfen den Therapieverlauf und den Status des Patienten besser
dokumentieren zu können, um damit eine Prognose hinsichtlich der Überlebenszeit besser beurteilen zu können.
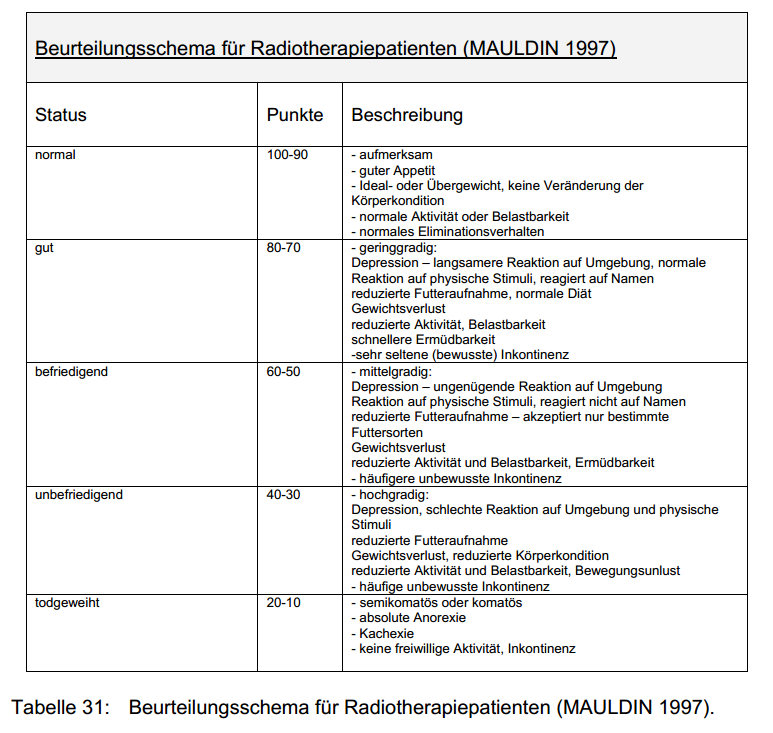
Der Einsatz ionisierender Strahlung hat ebenso Auswirkungen auf das Normalgewebe und führt durch die damit verbundene Schädigung zu Nebenwirkungen (WHITHERS 1975). Diese können sich akut oder chronisch äußern. Akute Reaktionen äußern sich als Entzündung des jeweiligen Gewebes und treten während oder kurz nach einer Therapie auf. Sie sind vor allem abhängig von der Gesamtstrahlendosis und betreffen Gewebe mit einer hohen Teilungsrate. Chronische Reaktionen können sich noch nach Jahren bemerkbar machen. Sie sind vor allem von der Fraktionsdosis abhängig und betreffen Gewebe mit einer langsamen Teilungsrate.
Gefäßstrukturen des Knochens weisen eine hohe Teilungsrate auf, die Zellen des Knochens eine langsame. Durch Gefäßschädigung kann es
zu Nekrosen und Fibrosen kommen (MATSUBAYASHI et al. 1981).
Zu den häufigsten Nebenwirkungen gehören Reaktionen der Haut und der Schleimhaut (ROBERTS et al. 1987; MAULDIN 1997; WHITE 1998). Diese reichen von der Ausbildung eines Erythems über eine feuchte Desquamation bis hin zur Nekrose. Ab Gesamtstrahlendosen von 40 Gy ist mit einer feuchten Desquamation zu rechnen, die Nekrose ist selten und erst ab sehr hohen Gesamtstrahlendosen zu beobachten.
Eine Alopezie tritt immer auf. Die Haare wachsen in der Regel nach, oftmals mit Pigmentveränderung. Eine simultane Anwendung von Chemotherapeutika, v.a. Doxorubicin kann zu einer intensiveren Hautreaktion führen. Im Zusammenhang mit einer Doxorubicinverabreichung kann als Spätfolge auch nach Jahren das sogenannte „radiation recall“, eine deutliche intensivere Hautreaktion, auftreten (WITHROW 1998). Die Behandlung der Irritationen besteht in einer symptomatischen Entzündungsbehandlung, eine Abheilung erfolgt in der Regel nach etwa 14 Tagen (WITHROW 1998).
Das Bestrahlungsfeld muss vor Automutilation geschützt werden. Von der Anwendung von Salben wird abgeraten, da sie die
Tiefenbestrahlung in weiteren Sitzungen behindern können.
4.3. PALLIATIVE THERAPIE
Grundsätzlich hat beim Tier der Erhalt oder die Wiederherstellung der Lebensqualität einen mindestens so hohen Stellenwert, wie das
Erreichen einer bestimmten Überlebenszeit. Ist ein kurativ zu erzielender Heilungserfolg nicht zu erreichen, so kann bzw. muss aus Tierschutzgründen eine palliative Behandlung (lat.: palliare:
mit einem Mantel bedecken) in Betracht gezogen werden (OGILVIE et al. 1993; WITHROW 1998; HILLERS et al. 2005; BOSTON et al. 2006). Auf diese Weise wird zeitweise eine Schmerzreduktion oder eine
Funktionsverbesserung erzielt. Gerade bei Patienten, die ungeeignet für einen chirurgischen Eingriff sind, deren Tumoren inoperabel sind, Patienten die ein Rezidiv entwickelt haben, Patienten die
klinisch relevante Metastasen entwickelt haben und bei Patienten bei denen eine konventionelle Therapie aus Kostengründen abgelehnt wird, ist es notwendig über eine palliative Therapie zumindest
einen Behandlungsversuch zu wagen, um über den Krankheitsverlauf, wenn auch nur für einen bestimmten Zeitraum, eine Kontrolle zu erlangen.
Die palliative Therapie ändert an der Ursache und dem tödlichem Verlauf der Erkrankung nichts. Daher muss der Besitzer vorab über das Behandlungsziel einer palliativen Therapie aufgeklärt werden.
Wie bereits beschrieben besitzt das Osteosarkom ein äußerst aggressives Potential (WITHROW 1998; DERNELL 2001). So gut wie jeder Patient, ungeachtet dessen wie er zunächst behandelt wird, erliegt nach unterschiedlicher Zeit den Folgen der Metastasierung (O’BRIEN et al. 1993; DOWNEY 1999).
Ein wesentlicher Bestandteil in der palliativen Behandlung des Osteosarkoms ist damit der Erhalt oder die Wiederherstellung einer erträglichen Lebensqualität (BRODERY et al. 1969; SHAPIRO et al. 1988; SPODNICK et al. 1992; BERG 1996; WITHROW 1998; ZACHOS et al. 1999; DERNELL et al. 2001).
4.3.1. PALLIATIVE RADIOTHERAPIE
Ein kuratives Behandlungsziel kann, wie bereits beschrieben, derzeit bei der Behandlung des Osteosarkoms in der Regel nicht und wenn, dann nur in besonders günstigen Fällen aufrechterhalten werden. Es kann jedoch versucht werden über eine palliative Radiotherapie zumindest eine Verbesserung der Lebensqualität und damit auch eine gewisse Verlängerung der Überlebenszeit zu erreichen (HEIDNER et al.1991; MCENTEE et al. 1993; BATEMAN et al. 1994; JAMESON et al. 1995; STRAW et al. 1996; DICKERSON et al. 2001; MUELLER et al. 2005; BARNARD et al. 2007).
Daher findet die palliative Radiotherapie bei der Behandlung des Osteosarkoms sowohl in der Humanmedizin als auch in der Veterinärmedizin eine deutlich häufigere Anwendung und muss sogar als Standardbehandlung in Betracht gezogen werden. Die palliative Radiotherapie wird vorwiegend in der Humanmedizin angewendet. Studien aus der Humanmedizin zeigten, dass bereits eine einzelne Dosis von 8 Gy genügt, um einen sinnvollen Effekt zu erreichen (STEENLAND et al. 1982; BONE PAIN TRIAL WORKING PARTY 1999). Eine einzige Dosis von 8 Gy wird demnach von den meisten Geweben gut vertragen und tötet 70–80% der Tumorzellen ab. Sie wird dort zur Behandlung von Patienten genutzt, bei denen die Erkrankung bereits im fortgeschrittenen Stadium ist, meist wenn es nach vorhergehender konventioneller Therapie zur Metastasierung und lokalen Rekurrenz gekommen ist. In der Veterinärmedizin findet die palliative Radiotherapie ihre hauptsächliche Anwendung in der erfolgreichen Schmerzbekämpfung im Zusammenhang mit Osteosarkomerkrankungen beim Hund (MCENTEE et al. 1993; BATEMAN et al. 1994; JAMESON et al. 1995).
Sie findet vor allem dann Anwendung, wenn kein chirurgischer Eingriff möglich ist, z.B. weil Lage und Ausmaß des Tumors es nicht
zulassen oder wenn bereits Metastasen klinisch in Erscheinung getreten sind (O’BRIEN et al. 1993; DOWNEY 1999; DERNELL et al. 2000; GREEN et al. 2002).
Außerdem ist sie verhältnismäßig kostengünstig und führt in der Regel hinsichtlich der Symptomatik zu einem schnellen sichtbaren Erfolg. Auf den Krankheitsverlauf nimmt sie alleinig angewendet keinen Einfluss.
Das Ziel der palliativen Radiotherapie besteht in erster Linie in der Verbesserung der Lebensqualität durch die Linderung von Schmerzen bzw. Verbesserung von Körperfunktionen (DICKERSON et al. 2001; HILLERS et al. 2005; BOSTON et al. 2006; BARNARD et al. 2007). Eine Verlängerung der Überlebenszeit kann zu einem gewissen Grad ebenso erreicht werden.
Der intravenöse Einsatz von Samarium Sm 153 Lexidronam in 4 Dosen (37MBq/kg) führte bei 35 Hunden zu einer mittleren Überlebenszeit von 93 Tagen und entspricht damit dem Effekt einer Amputation ohne adjuvante Behandlung (BARNARD et al. 2007). 63% der Tiere erfuhren hierbei eine deutliche Schmerzlinderung mit Rückgang der Lahmheit.
Nach DICKERSON et al. (2001) sollten für eine Verlängerung der Überlebenszeit jedoch höhere Dosen gewählt werden. Seiner Studie zufolge konnte mit definitiven Strahlungsdosen eine verlängerte Überlebenszeit erreicht werden. Mit palliativen Dosen erzielte er eine MST von 79 Tagen und mit definitiven Dosen eine MST von 265 Tagen. Die palliative Therapie kann damit auch zur Behandlung des Primärtumors genutzt werden, vor allem dann, wenn den Patientenbesitzern die konventionelle Therapie zu teuer ist bzw. wenn der chirurgische Eingriff aus anderen Gründen – Lage und Größe des Tumors, Gelenkschäden etc. nicht möglich ist. Immerhin wird auf diesem Wege eine gleichwertige mittlere Überlebenszeit erreicht wie sie auch bei einer alleinigen Amputation ohne zusätzliche Behandlungsmaßnahmen zu verzeichnen ist (HEIDNER et al. 1991; MCENTEE et al. 1993; STRAW et al. 1996; MUELLER et al. 2005).
Die palliative Radiotherapie kann damit eine echte Alternative zur Amputation darstellen. Bei einem Grad III Osteosarkom mit
klinischer Metastasierung sind nach
chirurgischem Eingriff und adjuvanter Chemotherapie mit einer zusätzlichen palliativen Radio- und Chemotherapie (MST 130 Tage) deutlich höhere Überlebenszeiten erzielt worden als ohne den Einsatz palliativer Therapieverfahren (MST 76 Tage) (BOSTON et al. 2006).
4.3.1.1. PALLIATIVE RADIOTHERAPIE ZUR BEHANDLUNG VON OSTEOSARKOMEN DES ANHANGSKELETTS
In der Regel wird eine palliative Radiotherapie mit 7 –10 Gy Fraktionen (60CoPhotonen) an den Tagen 0, 7 und 21 verabreicht (MCENTEE
et al. 1993; DERNELL et al. 1999; RAMIREZ et al. 1999). MC ENTEE et al. beschrieben 1993, dass von 15 Hunden, die an den Tagen 0,7 und 21 mit 10 Gy bestrahlt wurden, 12 Hunde bereits nach 1–3
Wochen eine deutliche Verbesserung der Gliedmaßenfunktion erfuhren, die im Mittel für 130 Tage andauerte. Einer anderen Studie zur Folge wurden Hunde mit appendikulärem Osteosarkom entweder mit
zwei Fraktionen à 8 Gy oder 3 Fraktionen à 10 Gy behandelt (RAMIREZ et al. 1999). 70 von 95 Hunden konnten die Schmerzen für durchschnittlich 73 Tage genommen werden. Ein Unterschied zwischen
beiden Behandlungsgruppen konnte hinsichtlich des Behandlungserfolges nicht festgestellt werden.
Eine neuere Studie erprobte bei 24 Hunden den Einsatz von 4x8 Gy (60Co) an den Tagen 0, 7,14 und 21. 92% der Tiere sprachen auf die Behandlung an (GREEN et al. 2002). Eine Behandlung in 4 Fraktionen scheint hierbei eine deutlichere Verbesserung hinsichtlich der klinischen Symptomatik und der Überlebenszeit zu erbringen. MUELLER et al. (2005) behandelten 54 Hunde entweder mit 3x8 oder 4x6 Gy. Bei 83% der Hunde führte die Therapie bereits während oder nach der Behandlung zu einer deutlichen Schmerzlinderung, die im Mittel 53 Tage anhielt. Damit entspricht die mit diesen Protokollen zu erzielende Wirkung den Protokollen mit dem Einsatz von Co-Photonen.
4.3.1.2. PALLIATIVE RADIOTHERAPIE ZUR BEHANDLUNG VON OSTEOSARKOMEN DES STAMMSKELETTS
25% der Osteosarkome beim Hund treten am Stammskelett auf (BRODERY und RISER 1969; HEYMAN et al. 1992). Aus anatomischen und physiologischen Gründen ist am Stammskelett ein chirurgischer Eingriff nicht immer möglich. Einige Berichte beschreiben den Einsatz der Radiotherapie zur Behandlung von axialen Osteosarkomen. In einer Studie wurden 15 Hunde mit einem Osteosarkom der Wirbelsäule zwischen 1986 und 1995 behandelt (DERNELL et al. 2000). 12 Hunde wurden operiert, um das Rückenmark zu entlasten, 7 der Hunde wurden mit OPLA-Pt behandelt, das intramuskulär nahe der Wirbelsäule implantiert wurde. 11 Tieren wurde Cisplatin intravenös verabreicht und 9 Hunde wurden mit fraktionierter Strahlung behandelt. Alle Hunde wurden entweder operiert, bestrahlt, oder erhielten beide Behandlungsformen. Zusätzlich erhielten alle Tiere eine Chemotherapie. 4 Hunde zeigten eine neurologische Verbesserung, 4 Hunde eine Verschlechterung und bei 6 Hunden trat überhaupt keine Veränderung auf. Die mittlere Überlebenszeit nach der Behandlung war relativ kurz, sie betrug 135 Tage.
In einer neueren Studie wurden 24 Hunde mit 4x8 Gy (60Co) an den Tagen 0, 7,14 und 21 bestrahlt. Etwa die Hälfte der Tiere
wies dabei Tumoren des Stammskelettes auf. 92% der Tiere reagierten positiv auf die Behandlung (GREEN et al. 2002). 4.3.2. PALLIATIVE RADIOTHERAPIE IN VERBINDUNG MIT EINER CHEMOTHERAPIE Nach
MCENTEE et al. (1993) bestand das Standart-Behandlungsregime aus drei Fraktionen à 8 Gy an den Tagen 0, 7 und 21 kombiniert mit vier oder mehr Gaben von Platinum-Chemotherapeutika, wobei die
ersten beiden Dosen am Tag 0 und Tag 21 verabreicht werden sollen.
Eine Kombination aus palliativer Radiotherapie (Gruppe A: 2x 8 Gy und Gruppe B: 3x 10 Gy) und intravenöser Chemotherapie mit mindestens 2 Dosen Carboplatin oder Cisplatin wurde 24 Hunden mit appendikulärem Osteosarkom verabreicht (MCENTEE et al. 1993). Alle Tiere waren bei Therapiebeginn frei von diagnostizierbaren Metastasen und hatten damit gute Voraussetzungen. 70% der Tiere wiesen eine deutlich verbesserte Gliedmaßenfunktion auf, die für durchschnittlich 150 Tage anhielt, wobei sich allerdings zeigte, dass der Effekt bei den Tieren der Gruppe A nur 90 Tage anhielt, bei den Hunden der Gruppe B jedoch 180 Tage. Diese Studie zeigt zum einen, dass eine Bestrahlung mit nur zwei Fraktionen à 8 Gy hinsichtlich der Prognose als unzureichend anzusehen ist, zum anderen zeigt sie, dass es sinnvoll sein kann, die palliative Radiotherapie in Kombination mit einem Chemotherapieprogramm anzuwenden.
Einer neueren Studie zufolge wurden 54 Hunde einer Elektronenstrahlung von 3x8 oder 4x6 Gy ausgesetzt (MUELLER et al. 2005). Zusätzlich wurde ihnen Carboplatin i. v. zeitgleich mit der Bestrahlung verabreicht. Es konnte eine schmerzfreie Zeit von im Mittel 53 Tagen ab Behandlungsbeginn erzielt werden. Die zusätzliche Gabe des Chemotherapeutikums hatte keinen Effekt auf den Behandlungserfolg.
Intraarteriell verabreichtes Cisplatin scheint das Osteosarkom jedoch strahlensensitiver zu machen (POWERS et al. 1996). Um
eine 80%ige Tumornekrose zu erreichen, ist mit einer alleinigen Radiotherapie eine Gesamtstrahlendosis von 42,2 Gy notwendig, wird Cisplatin intraarteriell verabreicht, reichen bereits 28,2 Gy
Gesamtstrahlendosis aus, um diesen Effekt zu erzielen. 4.3.3. PALLIATIVE RADIOTHERAPIE ZUR BEHANDLUNG VON METASTASTATISCHEN KNOCHENTUMOREN Hunde, die nur einer Amputation unterzogen werden,
sterben in der Folge an einer Metastasierung in die Lunge. Hunde, die eine Chemotherapie durchlaufen haben zeigen eine deutlich höhere Tendenz zu Knochenmetastasen. Der Zusammenhang ist nicht
geklärt (GIULIANO et al. 1984; HUTH und EILBER 1989).
Theorien nach HUTH und EILBER (1989):
- Klonselektion mit höherem Metastasepotential
- verlängertes Überleben lässt Metastasen klinisch in Erscheinung treten
- Hauptaugenmerk auf die Bekämpfung der Lungenmetastasen, Vernachlässigung der Knochenmetastasen
- keine Möglichkeit zur Diagnostik
– Knochenszintigraphie
Zwei Protokolle werden von STRAW et al. (1996) beschrieben: Tag 0,7 und 21 à 8 Gy Cobal-60 mit einer Gesamtstrahlendosis von 24
oder über 5 Tage je 4,5 Gy 6mV mit einer Gesamtstrahlendosis von 22,5 Gy. Die Schmerzstillung kann hierbei bis zu 6 Monate andauern, wobei die Symptome nach 2–3 Monaten wieder
beginnen.
III. DISKUSSION
Die Grundlage für die Wahl der Behandlungsoptionen des Osteosarkoms des Hundes ist eine genaue Einschätzung der klinischen Ausgangslage. Für die Zielstellung des Therapeuten sind vor allem die Tumorlokalisation, die Tumorgröße, das Krankheitsstadium und die Ausbreitungscharakteristika von Bedeutung. Sie werden vom histologischen Typ bestimmt, der wiederum im Zusammenhang mit der zu erwartenden Aggressivität (Zellproliferation) steht.
Stadium I Tumoren (ohne
Metastasen) zeigen deutlich höhere Grade als Stadium II und III Tumoren (mit Metastasen) (LOUKOPOULOS und ROBINSON 2007). Osteoblastische Osteosarkome weisen höhere Grade als
fibroblastische Osteosarkome auf. Junge Hunde in einem Alter unter 4 Jahren entwickeln Tumoren höheren Grades als Ältere.
Gliedmaßentumore und distal sitzende Tumoren weisen einen höheren Grad auf als Stammtumore und proximal gelegene Tumoren. Tumoren des Schädels weisen eine niedrige
Mitoserate auf, Rippentumoren hingegen eine sehr hohe Mitose- und Nekroserate.
Da hinsichtlich des Auskommens ein chirurgischer Eingriff unabdinglich ist, sind die Größe und die anatomische Lage des Tumors von entscheidender Bedeutung (LING et al. 1974). Eine geringe Tumorgröße begünstigt das therapeutische Auskommen (MISDORP und HART 1979; BROSTRÖM 1982; KUNTZ et al. 1998; LASCELLES et al. 2005).
Teleangiektatische Tumoren und Tumore der Rippen und des Schulterblattes neigen am stärksten zur Metastasierung und einer kurzen Überlebenszeit von 12 Tagen (HAMMER et al. 1995). Die mittlere Überlebenszeit der Tiere mit einem Osteosarkom an den Rippen beträgt 3 Monate, wenn die Patienten nur der Amputation unterzogen wurden und 8 Monate, wenn amputiert und gleichzeitig eine Chemotherapie durchgeführt wurde (MATTHIESEN et al. 1992; PIRKEY-EHRHART et al. 1995). Beim Osteosarkom des Schulterblattes zeigte sich nach Amputation und zusätzlicher Chemotherapie eine sehr schlechte Prognose beim Hund (HAMMER et al. 1995). Osteosarkome distal des Handwurzel- oder des Fußwurzelgelenkes weisen eine etwas längere Überlebenszeit (im Mittel 466 Tage) auf als solche mit proximaler Lokalisation, wobei sowohl die Aggressivität als auch die Gefahr der Metastasierung gleich hoch einzuschätzen sind (GAMBLIN et al. 1995). Das biologische Verhalten des Osteosarkoms am Stamm stellt sich ähnlich aggressiv dar wie an den Gliedmaßen, jedoch mit Ausnahme der Lokalisation am Unterkiefer, hier scheint die Prognose sehr günstig (STRAW et al. 1996; DICKERSON et al. 1998). Bei Hunden scheint zwar selten die Wirbelsäule betroffen zu sein, die beschriebenen Fälle zeigen jedoch sowohl lokal als auch systemisch eine hohe aggressive Potenz (MORGAN et al. 1980; HEYMAN 1992). In einem Bericht wurden 20 Tiere einer Behandlung mit Amputation, Chemo- und Strahlentherapie unterzogen, wobei die mittlere Überlebenszeit 4 Monate betrug (DERNELL und WITHROW et al. 2000). Die Lokalisation am Unterkiefer spricht für die beste Prognose. Hunde, die alleinig einer Amputation des Unterkiefers unterzogen wurden, wiesen in 71% der Fälle eine Überlebensrate von einem Jahr auf (KOSOVSKY et al. 1991; SCHWARZ et al. 1991; WHITE 1991; STRAW 1996). Anders liegt der Fall, wenn der Oberkiefer betroffen ist. Hier erreichten Hunde nur eine mittlere Überlebensrate von 5 Monaten (SCHWARZ et al. 1991; WALLACE et al. 1991). Ähnlich verhält es sich auch mit der Erkrankung anderer Schädelknochen, wobei die Tendenz von Schädel-Osteosarkomen zur Metastasierung in die Lunge im Allgemeinen deutlich geringer sein soll (HARDY et al. 1967; HAMMER et al. 1995). Osteosarkome, die in den Weichteilgeweben liegen, besitzen ebenfalls ein systemisch aggressives Verhalten und führen zu einer mittleren Überlebenszeit von 5 Monaten nach einem chirurgischen Eingriff und einer adjuvanten Therapie (KUNTZ et al. 1998; LANGENBACH et al. 1998). Hunde unter 5 Jahren reagierten schlechter auf die eingeleiteten Therapiemaßnahmen als ältere Hunde (SPODNICK et al. 1992). Eine geringe Körpergröße in Verbindung mit einem geringen Gewicht wirkt sich positiv auf die zu erwartende Prognose aus (HAMMER et al. 1995; LASCELLES et al. 2005).
Hinsichtlich des Krankheitsstadiums und der Ausbreitungscharakteristika muss mit abnehmender Prognosequalität zwischen dem
lokalisierten Osteosarkom (ohne klinische Metastasierung), dem Osteosarkom mit Lungenmetastasen, dem Osteosarkom mit extrapulmonalen Metastasen und dem Osteosarkomrezidiv unterschieden werden
(ENNEKING 1983). Ein kurativer Therapieansatz im engeren Sinne ist nur beim lokalisierten Osteosarkom ohne Metastasennachweis gegeben (CAMPANACCI et al. 1981; GIULIANO et al. 1984; BACCI et al.
1987; O’BRIEN et al. 1993; OGILVIE et al. 1993; DOWNEY 1999; DERNELL 2001). Auf Grund der verfügbaren hochpotenten Chemotherapie kann unter Umständen auch bei Patienten mit Lungenmetastasen eine kurative Zielstellung aufrechterhalten werden. Beim extrapulmonal metastasierenden Osteosarkom sowie beim
Osteosarkomrezidiv besitzt die Therapie von vornherein einen palliativen Charakter. Ansonsten muss als Alternative eine Euthanasie in Betracht gezogen werden.
Da fast alle Patienten an den Folgen einer Metastasierung sterben, steht vor allem das Erreichen einer
möglichst langen Überlebenszeit mit angemessener Lebensqualität im Mittelpunkt (BRODERY et al. 1969; SHAPIRO et al. 1988; SPODNICK et al. 1992; BERG 1996; WITHROW 1998; ZACHOS et al. 1999;
DERNELL et al. 2001). In 98% der Fälle hat zum Zeitpunkt der klinischen Manifestation bereits auf hämatogenem Wege eine okkulte Metastasierung stattgefunden (WITHROW 1998; DERNELL 2001). Ist eine
Metastasierung bereits klinisch nachweisbar, kann mit einer chirurgischen Therapie in Kombination mit einem adjuvanten Therapieverfahren keine signifikante Verbesserung der Überlebensrate erzielt
werden. Die Prognose ist hier als äußerst schlecht zu stellen (OGILVIE et al. 1993; WITHROW 1998; HILLERS et al. 2005; BOSTON et al. 2006). In diesem Fall scheint es sinnvoller palliative
Therapieverfahren in Betracht zu ziehen. Die Grundlage für einen kurativen Behandlungsansatz ist und bleibt der
chirurgische Eingriff. Therapieversuche ohne chirurgischen Eingriff resultieren in deutlich schlechteren Ergebnissen (BRODERY et al.
1969; MADEWELL et al. 1978; MAULDIN et al. 1988; SHAPIRO et al. 1988; SPODNICK et al. 1992; WITHROW 1996; ZACHOS et al. 1999). Beim Vorliegen pulmonaler Metastasen sollte ca. 6 Wochen nach dem
Primäreingriff die bilaterale thorakale Exploration und Resektion der Metastasen erfolgen.
25% der Osteosarkome beim Hund treten am Stammskelett auf (BRODERY und RISER 1969; HEYMAN et al. 1992). Ist der Primärtumor im
Kopfbereich lokalisiert, wird eine vollständige Mandibulektomie oder Maxillektomie empfohlen (KOSOVSKY et al. 1991; SCHWARZ et al. 1991; WALLACE et al. 1991; WHITE 1991; DERNELL et al. 1996; FOX
et al. 1997). Tumoren des periorbitalen Bereichs können erfolgreich per Orbiektomie entfernt werden (O’BRIEN et al. 1996). Rippentumoren können durch die Entfernung einer Brustwand mit einer
anschließenden Rekonstruktion der Seite erfolgreich reseziert werden (MATTHIESEN et al. 1992; PIRKEY-EHRHART et al. 1995; ALLEN et al. 1998). Tumoren der Wirbelsäule sind am schlechtesten
zu
behandeln. Komplette Wirbelentfernungen, wie sie in der Humanmedizin beschrieben werden, haben sich in der Veterinärmedizin nicht
durchgesetzt und chirurgische Eingriffe werden in der Regel nur zur Diagnosestellung oder zur Dekompression aufgrund neurologischer Defizite durchgeführt (DERNELL et al. 2000).
Ist das Osteosarkom an den Gliedmaßen lokalisiert, so kann der Chirurg zwischen einer Amputation oder einem gliedmaßenerhaltenden Eingriff (Limb-Sparing) wählen. Unter Beachtung der Resektionsränder führen bei gleicher chemotherapeutischer Begleitung beide Methoden zu einer vergleichbaren Überlebensrate (STRAW et al. 1996; DERNELL 2001). Aufgrund der ausgeprägten Malignität des Tumors und seiner hohen Rezidivrate, muss ein ausreichender Sicherheitsabstand für die Entfernung des Tumors angesetzt werden, dieses Ziel wird mit einer radikalen Resektion der betroffenen Gliedmaße vollständig erreicht. In der Regel wird amputiert, aber auch exartikuliert oder eine ganze Gliedmaße im Ansatz entfernt wie bei der Schultergürtelresektion oder Hemipelvektomie. Aus der Sicht des Operateurs liegen die Vorteile auf der Hand: Die radikale Resektion ist verhältnismäßig einfach und mit wenig Aufwand durchzuführen, sie verhält sich für den Besitzer kosteneffektiv, die Heilung der Wunde verläuft in der Regel komplikationslos und die Tiere kommen mit einer funktionellen Kompensation sehr gut zu recht (STRAW et al. 1996; WITHROW 1998; DERNELL 2001). Die Grundvoraussetzung für einen derartigen Eingriff ist eine gründliche Voruntersuchung, da bestehende schwere orthopädische und/oder neurologische Schäden durchaus ein ernsthaftes Problem für das Auskommen darstellen können (WITHROW 1998; DERNELL 2001). Der Hund muss in der Lage sein, diesen Eingriff konditionell zu verkraften und sein Leben auf drei Beinen bestreiten zu können. Das heißt er muss den Eingriff kompensieren können. Unter diesen Umständen kann ein derartiger Eingriff auch bei größeren und schwereren Hunden mit Erfolg durchgeführt werden (STRAW et al. 1996). Die meisten Hunde kompensieren schnell. Die durch die stärkere Belastung hervorgerufene beschleunigte Degeneration der verbliebenen Gliedmaßen stellt sich in Hinblick auf den weiteren Krankheitsverlauf als klinisch irrelevant heraus (WITHROW und HIRSCH 1979; CARBERRY und HARVEY 1987; BERG 1996).
Ist der Primärtumor an der Vordergliedmaße lokalisiert, so wird generell eine komplette Amputation der Gliedmaße empfohlen (STRAW et al. 1996; DERNELL 2001). Als Alternative kann bei Hunden, bei denen der proximale Teil der Scapula betroffen ist, eine Scapulektomie in Betracht gezogen werden (ENNEKING 1983; KIRPENSTEIJN et al. 1994; TROUT et al. 1995). Mit einer partiellen Scapulektomie bleibt die Funktionsweise der Gliedmaße gut erhalten, eine vollständige Entfernung mit Disartikulation des Schultergelenkes kann jedoch zu Gang- und Haltungsschwierigkeiten führen, die im weiteren Verlauf durch eine postoperative Physiotherapie begleitet werden müssen (DERNELL 2001; KIRPENSTEJN et al. 1994). Ist der Primärtumor an der Hintergliedmaße lokalisiert, so wird die Gliedmaße in Abhängigkeit des Sitzes der Läsion und dem chirurgischen Können des Operateurs im Bereich des proximalen Drittels des Femurs per Osteotomie abgesetzt (STRAW et al. 1996) oder besser unter Disartikulation des Hüftgelenkes entfernt (DERNELL 2001; STRAW et al. 1996). Sitzt der Tumor am proximalen Ende des Femurs oder haftet er dem Becken an, kann er nur durch eine Hemipelvektomie sinnvoll entfernt werden (STRAW et al. 1990 und 1992; DERNELL 2001). Betrifft er nur den proximalen Teil des Femurs, ist zumindest eine Amputation mit Acetabuloektomie durchzuführen, um in den proximalen Weichteilgeweben einen ausreichenden Sicherheitsabstand gewährleisten zu können (DERNELL et al. 2001). Diese Höhe des Eingriffes garantiert eine möglichst vollständige örtliche Entfernung des Prozesses und stellt sich sowohl kosmetisch als auch funktionell als beste Lösung dar. Kleine Primärtumoren der Ulna können durch eine teilweise Ulnektomie entfernt werden, eine Rekonstruktion mit Transplantaten oder Knochensubstanz kann dann unterbleiben. Sind die Mittelfußknochen betroffen, können örtliche Resektionen oder Amputationen durchgeführt werden. Kleine Hunde kommen mit der Entfernung der beiden medialen oder lateralen Zehen gut zurecht. Es zeigte sich, dass auch die Entfernung der mittleren zwei Mittelfußknochen gut toleriert wird. Derartige Entfernungen an großen Hunden wurden bis dato jedoch noch nicht beschrieben (DERNELL 2001).
Lokale Rezidive sind selten zu erwarten Knochens (WITHROW 1998). Treten diese auf, dann in der Regel nach einer teilweisen
Amputation und bei Tumoren mit Gelenkbeteiligung wie zum Beispiel bei der Osteotomie am Femur. Es sind dann Tumorzellen im Weichteilgewebe oder im Knochenmarkskanal verblieben, die zu einem
Rezidiv führen. Ist mit diesem Risiko aufgrund der proximalen Lage eines Tumors zu rechnen, wählt man besser die Disartikulation in einem Gelenk als die Osteotomie eines.
Die meisten Tiere kommen gut mit einer Gliedmaßenamputation zurecht. Unter bestimmten Umständen kann es jedoch erforderlich werden, gliedmaßenerhaltende Eingriffe (limb-sparing technics) durchzuführen. Besonders wenn die Tiere erhebliche orthopädische oder neurologische Schäden aufweisen, sehr groß sind oder die Besitzer eine Amputation nicht zulassen. Geeignete Kandidaten sind Hunde mit gutem Allgemeinbefinden, bei denen sich der Primärtumor an einer Gliedmaße befindet und nicht mehr als 50% des jeweiligen Knochens radiographisch in Mitleidenschaft gezogen sind (DERNELL et al. 2001). Extremitätenerhaltende Eingriffe sind in vielen Fällen möglich. Die onkologische Qualität, also die Radikalität des Eingriffes besitzt jedoch Vorrang gegenüber dem Funktionserhalt (ENNNEKING 1983, 1986, 1990). Am besten geeignet für Limb-Sparing Eingriffe scheinen Patienten, deren Tumorgeschehen sich auf den distalen Radius oder die Ulna beschränkt, eine Ausbreitung des Tumorgewebes ins Weichteilgewebe nur leicht bis mittelgradig stattgefunden hat und keine pathologische Fraktur vorliegt (WITHROW 1998; DERNELL et al. 2001).
Aufgrund des präoperativen Ansprechens auf die neoadjuvante Therapie in Verbund mit den Fortschritten in der CT- und MRT- Bildgebung, welche die anatomische Darstellung des Defektes erheblich präzisierten, waren in der Humanmedizin mit Beginn der 90er Jahre zwei Drittel der an Sarkomen erkrankten Patienten onkologisch geeignete Kandidaten für extremitätenerhaltende Eingriffe (HAM et al. 1998; GETTY und PEABODY 1999; MUSCOLO et al. 2000; RENARD et al. 2000; VASTEL et al. 2000). Dieser Umstand machte die Einführung verschiedener Rekonstruktionstechniken notwendig. Diese verfügen über unterschiedliche Einsatzmöglichkeiten mit verschiedenen Vor- und Nachteilen. Rekonstruktive Eingriffe können eingeteilt werden, in jene für diametaphysäre (engl.: intercalary) Defekte in den Röhrenknochen, jene für den Ersatz eines entfernten Gelenkes und jene die konventionelle Amputationstechniken modifizieren. Im Bereich der langen Röhrenknochen ist in fast allen Fällen eine zusätzliche Plattenstabilisierung notwendig, um den Defekt und das Substitut mechanisch zu stützen und damit die Heilung (engl.: creeping substitution) zu fördern(STRAW et al. 1992; KIRPENSTEIJN et al. 1998). Die Verwendung von Zement behindert den Heilungsprozess nicht wesentlich, trägt aber zu einer deutlich verbesserten Stabilität bei. Unter seiner Verwendung treten wesentlich weniger orthopädische Schäden, Transplantatbrüche oder Schraubenlockerungen auf.
Die Möglichkeiten zur Rekonstruktion von diametaphysären Defekten bestehen in konventionellen autogenen Knochentransplantaten,
vaskularisierten autogenen Transplantaten und Fremdknochentransplantaten (engl.: allografts). Werden aufgrund der anatomischen Ausbreitung des Tumors Gelenkstrukturen in die Resektion einbezogen,
so können die entstandenen Defekte durch verschieden Rekonstruktionsmethoden angegangen werden. Falls es hinsichtlich der zu erwartenden Praktikabilität möglich ist, so ist die einfachste Methode
eine Arthrodese der nach der Resektion übriggebliebenen Knochenanteile. Des Weiteren können sofern verfügbar Fremdknochen mit Gelenkanteil oder Prothesen eingesetzt werden. Eine weitere Option
besteht in der Kombination von Fremdknochen mit Prothesen (engl.: composite). Studien der Humanmedizin beschreiben für alle hier genannten rekonstruktiven Eingriffe eine
Fünf-Jahres-Überlebensrate von 60% (HAM et al. 1998; HORNICEK et al. 1998; GETTY und PEABODY 1999; MUSCOLO et al. 2000; RENARD et al. 2000; VASTEL et al. 2000).
Die Rotations- oder Umkehrplastik stellt im Prinzip eine Modifikation der konventionellen Amputation für Läsionen im Knie- und
Hüftbereich dar. In der Humanmedizin werden durch die Rehabilitation mit speziell angefertigten Exoprothesen, die die funktionellen Möglichkeiten für diese Patienten erheblich gebessert haben,
die anfänglichen psychologischen Probleme um ein vielfaches aufgewogen (WINKELMANN 1996; HILLMANN et al. 1999).
Für etwa 3-4 Wochen ist zu beachten, dass die Tiere nur eingeschränkt bewegt werden dürfen. Nach Ablauf dieser Zeit können sich die
Tiere wieder frei und uneingeschränkt bewegen. Es bleibt jedoch unbedingt erforderlich, dass die Gliedmaße so früh wie möglich postoperativ einer gewissen Belastung ausgesetzt wird, damit es
nicht zu einer Versteifung von Gelenken kommt. Alles in allem kann die Funktion der Gliedmaße nach der Anwendung des Limb-Sparing als zufriedenstellend beurteilt werden, da bei bis zu 80% der
Tiere gute bis exzellente Ergebnisse erzielt werden konnten (STRAW und WITHROW 1996). Der alleinige operative Eingriff birgt ohne zusätzliche Therapieverfahren hinsichtlich der Überlebenszeit
keinen signifikanten Vorteil (BRODERY et al. 1969; SHAPIRO et al. 1988; SPODNICK et al. 1992; ZACHOS et al. 1999). Die Lebensqualität der Tiere wird jedoch, wenn auch für kurze Zeit hervorragend
verbessert und größtenteils wiederhergestellt (BERG 1996).
Mit Hilfe adjuvanter Therapieverfahren kann die Prognose jedoch entscheidend verbessert werden. Gerade für eine Aufrechterhaltung eines kurativen Behandlungsziels oder zumindest für das Erreichen eines optimalen Auskommens muss adjuvant behandelt werden. Mit einer kombinierten adjuvanten Chemo- und Radiotherapie kann die Überlebenszeit um mehr als das Doppelte verlängert werden (BERG et al. 1997). Mit der adjuvanten Therapie wird eine Verbesserung der lokalen Kontrolle der während des chirurgischen Eingriffes erzielten Resektionsränder erreicht und damit die Wahrscheinlichkeit der Bildung eines lokalen Rezidivs minimiert. Mikroskopische Tumorreste in der reaktiven Zone sollen erfasst und eine Nekrose der Tumorzellen herbeigeführt werden. Adjuvante Verfahren werden vor allem lokal während und nach einem chirurgischen Eingriff angewandt. Im Mittelpunkt steht der Einsatz der Chemotherapie, die sowohl lokal als auch systemisch mit dem Vorteil der gleichzeitigen Fernmetastasenbekämpfung stattfindet. Hinsichtlich der zu erzielenden Überlebenszeit sind jedoch die zeit- und dosisabhängigen toxischen Nebeneffekte dieser Präparate von ernstzunehmender Wichtigkeit. Eine Reihe von Erprobungs- und Dosisfindungsstudien wurden daher in den letzten zwei Jahrzehnten unternommen. Mit den Studien der endachtziger und neunziger Jahre konnte aufgezeigt werden, dass der adjuvante Einsatz von Chemotherapeutika entscheidend für die Behandlung des Osteosarkoms ist. In dieser Zeit wurden mehrere Präparate vor allem in der „single-agent-therapy“ angewandt und erprobt. Mit Carboplatin (BERGMAN et al. 1996), Cisplatin (SHAPIRO et al. 1988; BERG et al. 1992; STRAW et al. 1992; THOMPSON und FUGENT 1992), Doxorubicin (BERG et al. 1995) und Lobaplatin (KIRPENSTEIJN et al. 1999/2000) wurden mittlere Überlebensraten von etwa 300 Tagen bei einer einjährigen Überlebensrate zwischen 30 – 40% erzielt. Das potenteste Präparat scheint Doxorubicin zu sein. Als single-agent kann demnach bei Doxorubicin bei einer Dosis von 30mg/m2 in 5 Sitzungen alle 14 Tage mit einer mittleren Überlebenszeit von 366 Tagen bei einer einjährigen Überlebensrate von 50,5% gerechnet werden (BERG et al. 1995). Doxorubicin wirkt durch seine Kardiotoxizität limitiert. Cisplatin führt zu einer verbesserten Lebenserwartung bei Hunden, die einer Amputation unterzogen wurden (MAULDIN et al. 1988; SHAPIRO et al. 1988). Die erforderliche Dosis für Cisplatin liegt bei 50-70 mg/m2, wobei eine ansteigende kumulative Dosis von Cisplatin die Überlebenswahrscheinlichkeit der Patienten deutlich steigert (MAULDIN et al. 1988; SHAPIRO et al. 1988; THOMPSON und FUGENT 1992; DERNELL et al. 1993; O’BRIEN et al. 1993). Bei Cisplatin ist die Nephro-toxizität der dosislimitierene Faktor. Man muss diesen Umstand über eine erhöhte Salzdiurese wirksam bekämpfen (OGILVIE et al. 1988).
Carboplatin ist ein gut verträgliches Chemotherapeutikum, das sicher in einer Dosis von 300 mg/m2 auf vier Gaben verteilt und im Abstand von 3 Wochen appliziert werden kann. Die auftretende Neutropenie wird als Dosis limitierend beschrieben (BERGMAN et al. 1996).
Eine maximale kumulative Dosis wurde noch nicht beschrieben (DERNELL et al. 2001). Trotzdem zeigen jüngere Studien mit der
gleichen Dosis keine derartigen Überlebenszeiten (KHANNA et al. 2000). Einer der Vorteile von Carboplatin ist, dass es ohne eine zusätzliche Salzdiurese, wie sie bei Cisplatin notwendig wird,
angewandt werden kann. Es kann zum Zeitpunkt der Amputation und in der Folge alle 21 Tage verabreicht werden, sofern es zu keiner schwereren Knochenmarkssuppression kommt. Um die hohen toxischen
Effekte des Doxorubicins zu senken, wird in jüngerer Zeit vorrangig die Polychemotherapie unter kombiniertem Einsatz zweier Präparate angewandt und evaluiert. In diesem Zusammenhang wurde
Doxorubicin (30mg/m2) einmal am ersten Tag verabreicht und in Kombination mit Carboplatin (300mg/m2) dreimal nach jeweils 21 Tagen. Es konnte eine mittlere Überlebenszeit von 202 – 260 Tagen
erzielt werden (BLAKE et al. 1999; KENT et al. 2004). Doxorubicin in Kombination mit Cisplatin scheint einen besseren Erfolg zu erzielen. Doxorubicin wurde in der Dosis 20mg/m2 zwei Stunden nach
dem chirurgischen Eingriff einmalig verabreicht, und Cisplatin in der Dosis 60mg/m2 in zwei Wiederholungen mit dem Abstand von 21 Tagen verabreicht. Bei 102 Hunden erreichte man damit eine
mitt-lere Überlebenszeit von 345 Tagen bei einer einjährigen Überlebenszeit von 48% und einer zweijährigen Überlebenszeit von 28% (BERG et al. 1997). Andere Dosisfindungsstudien über die
Kombination von Doxorubicin und Cisplatin weisen im Vergleich zu wenig Probanden auf, um eine Referenz daraus ziehen zu können (BLAKE et al. 1999; CHUN et al. 2000; CHUN et al. 2005). Eine neuere
Studie über den kombinierten Einsatz von Doxorubicin und Cisplatin rät davon ab, bereits am 2. Tag in den empfohlenen Dosen mit der Chemotherapie zu beginnen (DEREGIS et al. 2003). Die toxischen
Effekte scheinen zu diesem Zeitpunkt zu stark. Es wird eine zeitliche Aufschiebung der Behandlung mit einer Senkung der Doxorubicin Dosis auf 12,5-20mg/m2 empfohlen, wenn es in Kombination mit
60mg/m2 Cisplatin verabreicht werden soll.
Damit die Möglichkeit einer lokalen Rezidivierung von vornherein weitestgehend ausgeschlossen werden kann, muss eine vollständige
Resektion des betroffenen Areals erreicht werden. Daher erscheint es sinnvoll, das Tumorgewebe präoperativ und ebenso intraoperativ abzugrenzen. Dieser Umstand kann durch den Einsatz einer
neoadjuvanten Therapie erfolgen. Dieser Ansatz ist vor allem bei schlecht zugänglichen Tumoren und beim Limb-Sparing wichtig, da hierbei bedingt durch die eingeschränkte Radikalität des
Eingriffes die Gefahr einer lokalen Rezidivierung im Vergleich zur Amputation ungleich höher ist. Das Ziel der neoadjuvanten Therapie liegt darin, den Tumor im Vorfeld zu verkleinern und
abzugrenzen (Downstaging) und mögliche Mikrometastasen bereits im Vorfeld zu eliminieren. In der Humanmedizin wurde aufgezeigt, dass mit einer Strahlentherapie und einer systemische Chemotherapie
bei hochgradig bösartigen Knochentumoren nach festen Protokollen (COSS beim Osteosarkom, EICESS beim Ewing-Sarkom) im Vorfeld einer Operation eine Dickenproliferation der Pseudokapsel, eine
Verkleinerung der Tumormasse und die Beseitigung von Skip-, Satellitenabsiedlungen sowie Fernmetastasen erreicht werden kann. Es kommt zu einer Verkleinerung des Tumors (Downstaging) und einer
besseren Abgrenzung des Defekts. Beides erleichtert den chirurgischen Eingriff. Die Nekroserate des Tumors steht in Korrelation mit der lokalen Kontrolle des Tumorprozesses (ROSEN 1982; REMAGEN
et al. 1983; WINKLER et al. 1984; ROSEN 1986; KALIFA et al. 1995). Die hohe Wirksamkeit der neoadjuvanten Chemotherapie ist damit in der Humanmedizin sicher nachgewiesen und hat zu einer
entscheidenden Verbesserung der Behandlungsergebnisse (von ca. 20% auf 70% 5- Jahres-Überlebensrate) geführt (BIELING et al. 1991). Diverse Studien in der Veterinärmedizin führten zum gleichen
Resultat. Die Kombination aus Radio- und Chemotherapie führte sowohl prä- als auch intraoperativ zu einer deutlich geringeren lokalen Rezidivrate im Vergleich zu Patienten, die keiner derartigen
Behandlung unterzogen wurden (LARUE et al. 1989; STRAW et al. 1991; O’BRIEN et al. 1993; WITHROW et al. 1993; BERG et al. 1995; WITHROW 1998). Die Anwendung der Chemotherapie als einziges
Hilfsmittel führt bereits zu sinnvollen Ergebnissen hinsichtlich der Nekroserate von Tumorzellen (BERG et al. 1995; WITHROW 1998; DERNELL et al. 2001). Die Anwendung der Radiotherapie als
einziges Hilfsmittel führt zu unzureichenden Ergebnissen (THRALL et al. 1990; WITHROW et al. 1993). Zum Zeitpunkt des chirurgischen Eingriffes können außerdem Erfolg versprechend örtliche
Polymer-Chemotherapeutika eingebracht werden (STRAW et al. 1994; WITHROW et al. 1995; WITHROW et al. 1996; DERNELL et al.
1998; WITHROW 1998; DERNELL et al. 2000; DERNELL et al. 2001). In-vitro Versuche zeigen, dass der Einsatz von Meloxicam einer neueren Studie zufolge zu einer zeit- und dosisabhängigen Inhibition
des zellulären Wachstums in Osteosarkomzellen führt. Weitere Untersuchungen diesbezüglich sollen noch folgen (WOLFESBERGER et al. 2006). Aufgrund der hohen Rate okkulter Metastasen, insbesondere
pulmonaler Metastasen (WITHROW 1998), aber auch zur besseren Abgrenzung des Primärdefektes sollte die Behandlung also mit einer neoadjuvanten Radio- und Polychemotherapie beginnen.
Wie bereits beschrieben soll der Einsatz der Radiotherapie in Kombination mit einer Chemotherapie erfolgen (LARUE et al. 1989; STRAW
et al. 1991; O´BRIEN 1993; WITHROW et al. 1993; BERG et al. 1995; WITHROW 1998). Der alleinige Einsatz birgt keine nennenswerten Vorteile hinsichtlich des Auskommens (THRALL et al. 1990; WITHROW
et al. 1993). Eine Radiotherapie führt jedoch in jedem Fall zu einer gesicherten Nekrose von Tumorzellen, Fibrose, Kalzifikation und Bildung von Knochensubstanz (MATSUBAYASHI et al. 1981; THRALL
et al. 1990; WITHROW et al. 1993).
Eine erfolgreiche Tumorbekämpfung ist abhängig von der Gesamtdosis, die das neoplastische Gewebe erhält. Es muss über dem
Schwellenwert bestrahlt werden, wobei die Fraktionsdosis jedoch durch die Komplikationsrate, die Strahlentoxizität, limitiert wird. Insgesamt konnte gezeigt werden, dass mit moderaten
Fraktionsdosen hohe Gesamtstrahlendosen erreicht werden können, ohne dass nennenswerte Toxizitätssteigerungen auftreten (COUTARD 1931).
Idealerweise sollten Fraktionsdosen von 2 Gy oder weniger verwendet werden, eine Dosis von 3 Gy soll die obere Grenze sein. Sinnvoll
sind 3 Sitzungen pro Woche, empfohlen werden 5 Sitzungen, um die Pausen mit der Gefahr einer Tumorrepopulation nicht zu groß werden zu lassen (NOLTE und NOLTE 1999). Hinsichtlich der
Toxizitätserscheinungen einer Radiotherapie ist es unabdinglich, die Reaktion des Tumors, des gesunden Gewebes und des Patienten auf die radiotherapeutische Behandlung eingehend zu überwachen
(OGILVIE et al. 1991; MAULDIN 1997). Die Abstände zwischen den einzelnen Fraktionen dürfen nicht zu groß gewählt werden, da bereits nach einer 4 wöchigen Therapiepause eine deutlich schnellere
Repopulation beobachtet werden kann als anfangs beobachtet (WITHERS et al. 1988; NOLTE und NOLTE 1999).
Da derzeit das Behandlungsziel beim Osteosarkom, bedingt durch sein aggressives Verhalten, nur in besonders günstigen Fällen in
einem Heilungserfolg bestehen kann, kann versucht werden über eine palliative Radiotherapie zumindest eine Verbesserung der Lebensqualität und damit auch eine gewisse Verlängerung der
Überlebenszeit zu erreichen.
Daher findet die palliative Radiotherapie sowohl in der Humanmedizin als auch in der Veterinärmedizin eine deutlich häufigere Anwendung und kann sogar als Standardbehandlung in Betracht gezogen werden.
Grundsätzlich sollte beim Tier der Erhalt oder die Wiederherstellung der Lebensqualität einen mindestens so hohen Stellenwert
einnehmen, wie das Erreichen einer bestimmten Überlebenszeit. Die palliative Therapie ändert an der Ursache und dem tödlichem Verlauf der Erkrankung nichts. Daher muss der Besitzer vorab über das
Behandlungsziel einer palliativen Therapie aufgeklärt werden.
Wie bereits beschrieben besitzt das Osteosarkom ein äußerst aggressives Potential. So gut wie jeder Patient, ungeachtet dessen wie
er zunächst behandelt wird, erliegt nach unterschiedlicher Zeit den Folgen der Metastasierung. Ein wesentlicher Bestandteil in der palliativen Behandlung des Osteosarkoms ist damit der Erhalt
oder die Wiederherstellung einer erträglichen Lebensqualität.
Eine palliative Behandlung sollte dann in Betracht gezogen werden, wenn der Tumor nicht chirurgisch angegangen werden kann, vor
allem dann, wenn es die anatomische Lage des Tumors nicht zulässt oder der Besitzer den Eingriff ablehnt. Gerade bei lokalen Rezidiven und Metastasenbildung zum Zeitpunkt der klinischen
Erstvorstellung oder nach bereits erfolgter Primärtumorbehandlung, besteht wegen einer ausgeprägten Therapieresistenz und damit einer äußerst schlechten Prognose, in einer palliativen Behandlung
die einzig sinnvolle Behandlungsoption, um dem Tierschutzgesetz gerecht zu werden (OGILVIE et al. 1993; WITHROW 1998; HILLERS et al. 2005; BOSTON et al. 2006). Andernfalls ist dem Besitzer eine
Euthanasie seines Tieres anzuraten.
In der palliativen Behandlung des Osteosarkoms nimmt die Radiotherapie eine zentrale Bedeutung ein. Es ist sinnvoll diese mit einer
Chemotherapie zu kombinieren. Intraarteriell verabreichtes Cisplatin scheint das Osteosarkom jedoch strahlensensitiver zu machen. Um eine 80%ige Tumornekrose zur erreichen, ist bei einer
alleinigen Radiotherapie eine Gesamtstrahlendosis von 42,2 Gy notwendig.
Wird Cisplatin intraarteriell verabreicht, reichen bereits 28,2 Gy Gesamtstrahlendosis aus, um diesen Effekt zu erzielen (POWERS et
al. 1996).
Immerhin wird auf diesem Wege eine gleichwertige mittlere Überlebenszeit erreicht, wie sie auch bei einer alleinigen Amputation ohne
zusätzliche Behandlungsmaßnahmen zu verzeichnen ist (HEIDNER et al.1991; MCENTEE et al. 1993; JAMESON et al. 1995; STRAW et al. 1996; MUELLER et al. 2005). Hinsichtlich der hiermit zu erwartenden
Überlebenszeit kann auch ein chirurgischer Eingriff den palliativen Zweck erfüllen, falls dies technisch möglich ist (BERG 1996). Die palliative Radiotherapie wird vorwiegend in der Humanmedizin
angewandt. Studien der Humanmedizin zeigten dabei auf, dass bereits eine einzelne Dosis von 8 Gy genügt, um einen sinnvollen Effekt zu erreichen. Eine einzige Dosis von 8 Gy wird demnach von den
meisten Geweben gut vertragen und tötet 70-80% der Tumorzellen ab (STEENLAND et al. 1982; BONE PAIN TRIAL WORKING PARTY 1999).
In der Veterinärmedizin findet die palliative Radiotherapie ihre hauptsächliche Anwendung in der erfolgreichen Schmerzbekämpfung im
Zusammenhang mit Osteosarkomerkrankungen beim Hund (MCENTEE et al. 1993; BATEMAN et al. 1994; JAMESON et al. 1995; MUELLER et al. 2005). Der intravenöse Einsatz von Samarium Sm 153 Lexidronam in
4 Dosen (37MBq/kg) führte bei 35 Hunden zu einer mittleren Überlebenszeit von 93 Tagen und entspricht damit dem Effekt einer Amputation ohne adjuvante Behandlung (BARNARD et al. 2007). 63% der
Tiere erfuhren hierbei eine deutliche Schmerzlinderung mit Rückgang der Lahmheit. Nach DICKERSON et al. (2001) sollten für eine Verlängerung der Überlebenszeit jedoch höhere Dosen gewählt werden.
Seiner Studie zufolge konnte mit definitiven Strahlungsdosen eine verlängerte Überlebenszeit erreicht werden. Mit palliativen Dosen erzielte er eine MST von 79 Tagen und mit definitiven Dosen
eine MST von 265 Tagen.
Beim Grad III Osteosarkom mit klinischer Metastasierung sind nach dem chirurgischem Eingriff und einer adjuvanten Chemotherapie mit
einer zusätzlichen palliativen Radio- und Chemotherapie (MST 130 Tage) deutlich höhere Überlebenszeiten erzielt worden als ohne (MST 76 Tage) (BOSTON et al. 2006). In der Regel wird eine
palliative Radiotherapie mit 7 – 10 Gy Fraktionen (60CoPhotonen) an den Tagen 0, 7 und 21 verabreicht (MCENTEE et al. 1993; DERNELL et al. 1999; RAMIREZ et al. 1999).
Ein neuere Studie erprobte bei 24 Hunden den Einsatz von 4x8 Gy (60Co) an den Tagen 0, 7, 14 und 21. 92% der Tiere sprachen auf die
Behandlung an (GREEN et al. 2002). Eine Behandlung in 4 Fraktionen scheint hierbei eine deutlichere Verbesserung hinsichtlich der klinischen Symptomatik und der Überlebenszeit zu erbringen.
MUELLER et al. (2005) behandelten 54 Hunde entweder mit 3x8 oder 4x6 Gy. Bei 83% der Hunde führte die Therapie bereits während oder nach der Behandlung zu einer deutlichen Schmerzlinderung, die
im Mittel 53 Tage anhielt. Damit entspricht die mit diesen Protokollen zu erzielende Wirkung denen mit CoPhotonen Einsatz.
Wie bereits beschrieben treten 25% der Osteosarkome am Stammskelett auf. Aus anatomischen und physiologischen Gründen ist am
Stammskelett ein chirurgischer Eingriff nicht immer möglich. Gerade hier konnte auch eine zufriedenstellende Wirkung der palliativen Radiotherapie gezeigt werden (DERNELL et al. 2000; GREEN et
al. 2002).
IV. ZUSAMMENFASSUNG
Zum Osteosarkom – eine vergleichende Literaturstudie
Das
Osteosarkom kommt beim Hund selten vor, dennoch ist es der häufigsteKnochentumor des Hundes.
Vornehmlich sind großwüchsige, ältere Hunde betroffen.Der Tumor ist am häufigsten an der
Vordergliedmaße lokalisiert. Die Diagnose wirdhistologisch gestellt, obwohl die typischen
radiologischen Veränderungen desOsteosarkoms in der Regel sehr charakteristisch sind. Die zu
erwartende Prognosewird als schlecht eingestuft. Zum Zeitpunkt der klinischen Diagnose sind
bereits inmehr als 90% der Fälle Mikrometastasen entwickelt. Die Mehrzahl der Tiere stirbt
mitoder ohne eine Behandlung nach einer bestimmten Zeit an den Folgen einerMetastasierung. In den letzten Jahren haben jedoch verschiedene chirurgische undmedikamentelle Therapieversuche zu einer deutlichen Verbesserung derLebensdauer und -qualität der betroffenen Tiere geführt. Es stehen definitive undpalliative Therapieansätze zur Verfügung. Für eine definitive Zielsetzung ist derchirurgische Eingriff in Form einer Amputation oder eines Limb-Sparing Eingriffesdas Mittel der Wahl. Soll eine definitive Zielstellung aufrechterhalten werden, somuss der chirurgische Eingriff in Kombination mit einer adjuvanten Behandlungdurchgeführt werden. Mit einer adjuvanten Chemotherapie unter Einsatz vonCisplatin und/ oder Doxorubicin kann eine deutliche Verlängerung derÜberlebenserwartung erzielt werden. Durch eine neoadjuvante Chemo- oderRadiotherapie kann der tumoröse Prozess im Vorfeld des operativen Eingriffesdeutlich minimiert werden (Downstaging) und damit die folgende Operation und diespätere Tumorkontrolle erheblich erleichtert werden. Wird von einem operativenEingriff abgesehen, so müssen palliative Verfahren angewendet werden, um eineakzeptable Lebensqualität weiterhin gewährleisten zu können. In diesemZusammenhang wird vor allem die palliative Radiotherapie erfolgreich eingesetzt.
V. SUMMARY
Osteosarcoma – a retrospective study
In dogs
osteosarcoma is rare, but it is the most common primary bone tumordiagnosed in dogs. Most
osteosarcomas occur in large and older dogs. Most frequentlocation site of osteosarcoma in dog
is the forderlimb. Diagnosis depends onhistological evaluation, but in radiological examinations
the typical signs are verycharacteristic. Dogs with osteosarcoma have an poor prognosis. In more
than 90% ofcases micrometastases have been developed at time of clinical presentation.
Beeingtreated or being not treated most of the dogs die on the effects of metastatic
disease.Studies of the last years showed that the usage of different surgical and
medicaltreatment options results in an improvement of quality of life and survival.
Thetreatment options are both definitive and palliative. Chosing an definitive task
fortreatment of osteosarcoma the surgical treatment of the affected site by
amputationor limb-sparing is the basic option. It must be combined with adjuvant treatment.
Theusage of cisplatin and/ -or doxorubicin results in an significant improvement ofsurvival. With the usage of neoadjuvant treatment the tumor process can beminimized on a stage that improves surgical treatment and after operation the controlof process, by downstaging. Is no chance for surgical treatment, palliative treatmentoptions must be considered to provide pain control and an acceptable quality of life.In this case radiotherapy is an successful option.
Share this article / Teilen Sie diesen Artikel
Diese Webseite wurde mit Jimdo erstellt! Jetzt kostenlos registrieren auf https://de.jimdo.com