Article added / Artikel hinzugefügt 01.10.2021
Generally Articles and Discussions about Osteosarcoma in Dogs
→ Evaluations of phylogenetic proximity in a group of 67 dogs with
osteosarcoma: a pilot study
Article added / Artikel hinzugefügt 01.10.2021
Generally Articles and Discussions about Osteosarcoma in Dogs
→ Canine Periosteal Osteosarcoma
Images added / Abbildungen hinzugefügt 02.05.2019
Generally Sonography Atlas of Dogs →
Cardiovascular system → Pulmonary vessels
New subcategory added / Neue Unterkategorie hinzugefügt 02.05.2019
Generally Sonography Atlas of Dogs →
Cardiovascular system → Pulmonary vessels
Images added / Abbildungen hinzugefügt 01.05.2019
Generally Sonography Atlas of Dogs →
Cardiovascular system → Heart valvular diseases



Palliative Bestrahlung mit 60Co-Teletherapie beim appendikularen Osteosarkom des Hundes

Bettina Kandel-Tschiederer, "Palliative Bestrahlung mit 60Co-Teletherapie beim appendikularen Osteosarkom des Hundes", 04.06.2009, http://www.qucosa.de/fileadmin/data/qucosa/documents/3569/Kandel-TschiedererBettina-2009-01-13.pdf

| Klassifikation: |
|
| Datum: |
|
| Format: |
|
| Typ: | |
| Sprache: |
|
| Zuordnung: |
|
| Volltext: | |
| Herkunft aus Repository: | |
| Ähnlichkeiten: | |
| OAI/PMH-Record: |
VERZEICHNIS DER ABKÜRZUNGEN
ALKP/AP Alkalische Phosphatase
ALT Alanintransaminotransferase
AST Aspartataminotransferase
BALP knochenassoziierte Alkalische Phosphatase
CALP kortikosteroidinduzierte Alkalische Phosphatase
CK Creatinkinase
CR komplette Remissionγ-GT Gammaglutamyltransferase
GLDH Glutamat-Dehydrogenase
Gy GrayLahmhgr. Lahmheitsgrad
LALP leberassoziierte Alkalische Phosphatase
LDH Laktatdehydrogenase
MBq Megabecquerel
mCi Millicurie
M-M-F Montag-Mittwoch-Freitag
NSAID nichtsteroidales Antiphlogistikum
OP Operation
OSA Osteosarkom
PR partielle Remission
RBC Erythrozyten (red blood cells)
Rx Bestrahlung
TALP
Gesamt-Alkalische Phosphatase
1 Einleitung
Kleine Haustiere nehmen in immer stärkerem Maße eine Stellung ähnlich der von Familienmitgliedern ein und
erreichen aufgrund einer verbesserten medizinischen Versorgung,Ernährung und Haltung ein höheres
Lebensalter. Dies führt dazu, dass in der tierärztlichenKleintierpraxis zunehmend Tiere mit dem
Krankheitsspektrum älterer und geriatrischerPatienten vorgestellt werden. Neben der Behandlung
verschiedener altersbedingter Organerkrankungen gewinnt damit auch die Behandlung von Tumorerkrankungen an Bedeutung.Da Hunde und Katzen den Lebensraum des Menschen unmittelbar teilen und somit ähnlichenUmwelteinflüssen unterliegen, kommen ihnen auch Indikatorfunktionen für Erkrankungen desMenschen zu. Der relativ begrenzte genetische Pool bei Rassehunden lässt darüber hinausgenetische Faktoren bei der Entstehung von Erkrankungen deutlicher zutage treten als diesbeim Menschen der Fall ist. Da in der Ätiologie neoplastischer Erkrankungen sowohl genetische als auch
Umweltfaktoren eine Rolle spielen, gilt der Kleintieronkologie von humanmedizinischer Seite besondere Aufmerksamkeit (WITHROW et al. 1991). Osteosarkome kommenbeim Hund häufiger vor als beim Menschen und zeigen bei beiden Spezies ein vergleichbaresbiologisches Verhalten. Erkenntnisse aus der Erforschung dieser Erkrankung beim Hund sinddaher für die Humanmedizin von größtem Interesse.
Die klinischen Erfahrungen in Deutschland zeigen, dass ein Großteil der Tierbesitzer
eineGliedmaßenamputation bei ihrem Hund aus persönlichen beziehungsweise ethischen
Gründengrundsätzlich ablehnt. Zwar gibt es Beweise in der Tiermedizin (CARBERRY und
HARVEY1987, KIRPENSTEIJN et al. 1999), dass auch großwüchsige Hunde nach einer
Amputationeine gute Lebensqualität haben, doch muss eine vom Besitzer geäußerte Ablehnung
einerAmputation vom Arzt respektiert werden. Darüber hinaus lassen orthopädische und
neurologische Begleiterkrankungen eine Gliedmaßenamputation in manchen Fällen aus medizinischerSicht nicht ratsam erscheinen. Nicht zuletzt ist eine Operation mit nachfolgender Chemotherapie mit einem
erheblichen finanziellen Engagement seitens der Besitzer verbunden.
Die palliative Bestrahlung von Osteosarkomen bietet die Möglichkeit eine
Wiederherstellungder Gliedmaßenfunktion zu erreichen. Die beschriebenen Überlebenszeiten
entsprechen deneneiner Gliedmaßenamputation ohne Chemotherapie. Die Optimierung des
Bestrahlungsprotokolls ist daher ein wichtiges Ziel der veterinärmedizinischen Radioonkologie.
Dieser Arbeit liegt folgende Aufgabenstellung zu Grunde:
1. Dokumentation der Wirkung fraktionierter palliativer 60Cobalt-Bestrahlung beim caninenappendikularen Osteosarkom.
2. Überprüfung eines Zusammenhanges zwischen Tumorstadium (Muskelatrophie der betroffenen Gliedmaße, Tumorlängenausdehnung im Knochen, Lyseindex des Tumors, Lungenmetastasen)und Behandlungserfolg.
3.
Vergleich zweier Bestrahlungsprotokolle zur Schmerztherapie appendikularer Osteosarkomehinsichtlich Wirksamkeit, Wirkungseintritt, Wirkungsdauer, Nebenwirkungen, Wiederholbarkeitund Überlebenszeit.
2 Literaturübersicht
2.1 Canines Osteosarkom
2.1.1 Epidemiologie
Beim Hund
kommen unter den primären malignen Tumoren der Knochen die Osteosarkome mit85 % am weitaus
häufigsten vor (Inzidenz 6,5 pro 100.000 Tiere) (PRIESTER 1980). Die restlichen15 % verteilen
sich auf Chondro-, Fibro-, Hämangiosarkome und Riesenzelltumoren. Knochenmetastasen anderer Primärtumoren, hier vor allem Karzinome der Mamma, Leber, Lunge, Schilddrüseund Prostata, treten relativ selten auf. Benigne Neoplasien und Veränderungen des Knochens, wiezum Beispiel Osteome, Enchondrome, multiple kartilaginäre Exostosen, Knochenzysten undKnocheninfarkte, gibt es beim Hund nur selten.
Das Osteosarkom hat beim Hund einen Anteil von 6 % aller bösartigen Neoplasien
(PRIESTER1980). Überproportional häufig sind Vertreter schnellwüchsiger, großer Rassen und
Riesenrassenbetroffen, bei denen der appendikulare Anteil des Skeletts im Vergleich zum axialen
mit 95 %dominierend befallen wird. Bei Hunden unter 15 kg, die nur 5 % aller
Osteosarkompatientendarstellen, manifestieren sich Osteosarkome zu 60 % im axialen Skelett
(COOLEY und WATERS1997, KISTLER 1981). Osteosarkome sind eher bei mittelalten bis älteren Hunden
(Durchschnittsalter sieben Jahre) zu finden. Vereinzelt wird jedoch auch ein sehr frühes Vorkommen mit sechs bissieben Monaten beschrieben (PHILLIPS et al. 1986). Manche Studien berichten von einer Prädisposition für
männliche Tiere sowie in Deutschland für Vertreter der Rassen Rottweiler, DeutscherSchäferhund,
Doggen, Boxer und Bernhardiner.
Bevorzugte Lokalisationen im Knochen sind die metaphysären Bereiche der langen Röhrenknochen,
hierbei in absteigender Reihenfolge der Häufigkeit die distale Radius-, proximale Humerus-,distale Femur-, proximale Tibia-, distale Ulna- und distale Tibiametaphyse. Die Vorderextremitä-ten, die zwei Drittel des Gesamtkörpergewichts tragen, sind im Vergleich zu den
Hinterextremitätendoppelt so häufig betroffen (KNECHT und PRIESTER 1978, ROSENBERGER et al.
2007).
2.1.2 Ätiologie
Bisher gibt es wenige bewiesene Ursachen für die Entstehung von Osteosarkomen. Es existiereneher gut begründete Hypothesen. Da bevorzugt die spät schließenden Wachstumsfugen dervermehrt Gewicht tragenden Knochen betroffen sind, werden als Tumorätiologie multiple Mikrotraumen und auch
einzelne Verletzungen vor allem im Bereich der Wachstumszonen mitverantwortlich gemacht (KNECHT und PRIESTER 1978). TJALMA (1966) postulierte den Zusammenhang zwischen einer Osteosarkomentstehung
im appendikularen Skelett und der Größe beziehungsweise dem Gewicht des Tieres. PONOMARKOV (1983) vermutete, dass größere Hunde einehöhere Inzidenz an Osteosarkomen haben, da sie einer intensiveren Knochenformation unterworfensind als dies bei kleinen Hunden der Fall ist. Größere Hunde erfahren schon während des Wachstums eine
höhere physikalische Belastung des Knochens. Auch die Lokalisation der appendikularenOsteosarkome spiegelt diesen Erklärungsansatz wider. Neben der gesteigerten Inzidenz für canineappendikulare Osteosarkome im Bereich der vermehrt gewichtstragenden Vordergliedmaßenbesteht nach PONOMARKOV (1983) auch eine Prädisposition für sich spät schließende epiphysäreWachstumsfugen.
Trauma- oder frakturassoziierte Osteosarkome können im Rahmen der physiologischen Frakturheilung
auftreten. Sie sind jedoch vor allem dann zu beobachten, wenn die Wundheilung durchInfektionen,
Instabilität oder andere Ursachen verzögert abläuft (SINIBALDI et al. 1976). Eswerden
verschiedene initiierende Faktoren bei der Entstehung von fraktur- oder implantatassoziierten Osteosarkomen diskutiert. Dazu gehören Metall und Korrosion des Metalls, Elektrolysezwischen zwei ungleichen Metallen (SINIBALDI et al. 1982), begleitender Gewebeschaden,veränderte Zellaktivität im Zusammenhang mit der Frakturheilung und chronische Irritation durchbakterielle Osteomyelititis (SINIBALDI et al. 1976, STEVENSON 1991). KNOBLOCH (1990)beschrieb, dass frakturassoziierte Osteosarkome vor allem dann entstehen, wenn Infektionen oderandere Faktoren die Knochenheilung beeinträchtigen oder Fremdkörper lange im Knochen verbleiben. In einer
großen Studie mit 222 Hunden stellte man hingegen kein erhöhtes Risiko für Osteosarkomentstehung bei Metallimplantaten fest (LI et al. 1993).
Bei Katzen spielen Frakturen für die Osteosarkomentstehung im appendikularen Skelett
einegrößere Rolle als dies beim Hund der Fall ist (KNOBLOCH 1990). Die meisten der
frakturassoziierten Osteosarkome sind im Bereich der Diaphyse zu finden. Mit über 50 % ist am häufigsten dieFemurdiaphyse betroffen. Das durchschnittliche Zeitintervall zwischen Fraktur und Osteosarkomentstehung
liegt bei 5,5 Jahren (STEVENSON et al. 1982).
Fremdkörper anderer Art können ebenso Ursache für eine chronische Stimulation mit nachfolgender
Tumorentstehung sein. PARDO und Mitarbeiter (1990) beschrieben ein jejunales Osteosarkomim
Zusammenhang mit einem im Abdomen verbliebenen Tupfer. Osteosarkome im Oesophaguskönnen durch
eine Infektion mit Spirocerca lupi hervorgerufen werden (MAZAKI-TOVI et al.2002, THRASHER et al.
1968).
Auch
hereditäre, familiäre, genetische und hormonelle Ätiologien werden diskutiert. Die hereditäreKomponente wird von einer Studie unterstützt, die bei Patienten mit einem (hereditären) Retinoblastom ein
500fach gesteigertes Vorkommen von Osteosarkomen beschreibt (GOORIN et al.1985). MENDOZA und
Mitarbeiter (1998) konnten hingegen bei keinem ihrer Patienten eineVeränderung im Sinne eines
hereditären Retinoblastoms nachweisen. BECH-NIELSEN undMitarbeiter (1978) propagierten, dass ein
spezifisches Gen bei Bernhardinern die Prädisposition fürOsteosarkome steigert. Sie fanden
Osteosarkome bei sechs von 148 Verwandten ersten Grades von21 Index-Bernhardinern, bei den 110
Kontrollhunden wurde keine vergleichbare Tumorprävalenzfestgestellt.
Verschiedene Untersucher wiesen eine signifikante Amplifikation von bestimmten Onkogenen
wiec-sis, c-myc und dem MET-Onkogen in spontan vorkommenden Osteosarkomen und
Osteosarkomzelllinien in vitro nach. Die Bedeutung dieser Erkenntnis ist jedoch noch nicht näher bekannt. Auchdas Tumorsuppressorgen p53 ist bei Osteosarkomen häufig verändert (JOHNSON et al. 1998,MENDOZA et al. 1998, SETOGUCHI et al. 2001, VAN LEEUWEN et al. 1996). Eine Studie derUniversität Utrecht konnte bei 42 % der caninen Osteosarkome Mutationen im Tumorsuppressorgen p53
nachweisen. Mit Hilfe einer Multivarianzanalyse wurde berechnet, dass Tiere mit Mutationdieses
Gens kürzere Überlebenszeiten aufwiesen als solche ohne Veränderungen der entsprechenden Gensequenz (VAN LEEUWEN et al. 1996).
Der Beweis dafür, dass Osteosarkome durch ionisierende Strahlung induziert werden können,wurde
mehrfach in verschiedenen Beaglekolonien erbracht (LLOYD et al. 1993, LLOYD etal.1994, RAABE und
PARKS 1993, SHYR und MUGGENBURG 1992, WHITE et al. 1994). Nachder Applikation
knochenanreichernder Radionuklide wie 226Ra, 90Sr,
241Am und 239Pu
konnte eineInkorporation der Radionuklide in die Matrix des sich entwickelnden Knochens
nachgewiesenwerden. Die daraus resultierende lebenslang erhöhte Strahlenbelastung des Skeletts
führte zu einerInzidenzsteigerung für Osteosarkome auf bis zu 53 %.
Auch intraoperative und konventionelle Teletherapie führt zu einem erhöhten Risiko für
dieEntwicklung von Osteosarkomen. POWERS und Mitarbeiter (1989) haben in 12-21 % der
Fälleeine Entstehung von Osteosarkomen im Bestrahlungsfeld vier bis fünf Jahre nach
intraoperativerBestrahlung beobachtet. Dieser Zusammenhang wurde später durch andere Autoren
bestätigt(BARNES et al. 1990, GILETTE et al. 1990).
Osteosarkome des Menschen enstehen im Bereich des maximalen Knochenwachstums, so dass
einZusammenhang zwischen Tumorentstehung, hormoneller Stimulation und gesteigerter
Osteoblastenaktivität zu bestehen scheint. Das somatotrope Hormon (=Wachstumshormon, englisch Growthhormon=GH), das für das lineare Wachstum von Knochen verantwortlich ist, könnte in diePathogenese der Osteosarkome involviert sein. Bei 25 % der untersuchten Osteosarkome wurdeeine lokale GH-Expression nachgewiesen, was als ein echtes autokrines Phänomen interpretiertwerden kann (KIRPENSTEIJN et al. 1999, KIRPENSTEIJN et al. 2002). In einer Folgestudie, inder 55 primäre Osteosarkome untersucht wurden, konnten lokale GH-Produktion und GHRezeptoren vor allem bei
höhergradigen Tumoren nachgewiesen werden. Hierbei war der Nachweisvon GH mit einem erhöhten
Risiko für kürzere krankheitsfreie Intervalle und Überlebenszeitenvergesellschaftet
(KIRPENSTEIJN et al. 2002).
2.1.3 Biologisches Verhalten
Per definitionem sind Osteosarkome maligne mesenchymale Neoplasien, die mit der Produktionvon Knochengrundsubstanz (Osteoid) und/oder trabekulärem Knochen einhergehen. Sie entstehentypischerweise innerhalb des Knochenkortex und führen mit zunehmendem Wachstum zunächst zurlokalen Destruktion der Spongiosa und dann des Kortex. Periostale Osteoproliferation und Weichteilschwellung resultieren in einer Auftreibung des betroffenen Gliedmaßenabschnitts. Im Endstadium kommt es nicht selten zu pathologischen Frakturen des Knochens (MADEWELL et al. 1978,OWEN 1962).
Zusätzlich zum destruktiven Lokalverhalten haben canine Osteosarkome eine hohe Neigung zurhämatogenen Metastasierung vor allem in die Lunge, aber auch in andere Knochen. Daneben sindMetastasen in Niere, Leber, Darm, Blase, Herz, Nebennieren oder Unterhaut beschrieben (OWENund STEVENSON 1961, WATERS et al. 1997). Zu einem kleineren Anteil streuen sie auchlymphogen in die regionalen Lymphknoten (HILLERS et al. 2005, KIRPENSTEIJN et al. 2002).Zwar kann man nur bei circa 10 % aller Osteosarkompatienten zum Zeitpunkt der Diagnosemakroskopisch Metastasen nachweisen, doch lässt sich aus der Literatur entnehmen, dass selbstnach radikaler Tumorentfernung (Gliedmaßenamputation) in fast allen Fällen mit einer Metastasierung zu
rechnen ist (DERNELL et al. 2001). Es ist davon auszugehen, dass bei etwa 90 % derPatienten zum
Zeitpunkt der Erstdiagnose Mikrometastasen präsent sind (DERNELL et al. 2001,MISDORP und HART
1979). Nach chirurgischer Entfernung des Primärtumors und mit zunehmendem Einsatz von Chemotherapeutika wird ein größerer Anteil an Knochenmetastasen nachgewiesen (BERG et al. 1992, STRAW et al.
1990).
Bei Hunden mit Osteosarkom werden gelegentlich diffuse, medulläre Knocheninfarkte
beobachtet(DUBIELZIG et al. 1981), die mit Metastasen verwechselt werden können. Die Ursache für
dieseInfarkte und die medizinischen Konsequenzen sind bisher noch unbekannt. Bei einem
Hundentwickelte sich ein Osteosarkom an der Stelle eines Knocheninfarkts fünf Jahre nach
einerHüftarthroplastik (MARCELLIN-LITTLE et al. 1999).
2.1.4 Klinisches Bild
Patienten mit Osteosarkom werden in der Regel wegen Lahmheit und schmerzhafter Schwellungder betroffenen Gliedmaße vorgestellt (JONGEWARD 1985, OWEN und STEVENSON 1961,PIRKEY-ERHART et al. 1995). Die Entstehung der Schmerzen lässt sich durch Osteolyse desKortex, Spannung und Zerreißung des stark innervierten Periosts, Druck auf das Weichteilgewebe,Kompression der Nerven und Mikrofrakturen erklären (KIRPENSTEIJN 2003, MAYER undGRIER 2006). Die Lahmheit ist zunächst meist intermittierend und geringgradig. Innerhalb wenigerWochen bis Monate kommt es jedoch im Regelfall zur hochgradigen Lahmheit. Gelegentlich wirdein leichteres Trauma als auslösende Ursache erwähnt, was anfänglich irreführend sein kann.Die begleitende Schwellung variiert in der Konsistenz von weich über derb bis knochenhart. Beiperakuten, höchstgradigen Lahmheiten muss die Möglichkeit einer pathologischen Fraktur inBetracht gezogen werden (MADEWELL et al. 1978). Begleitend ist häufig eine Atrophie derMuskulatur der betroffenen Gliedmaße festzustellen. Lungenmetastasen führen eher selten zurespiratorischen Problemen wie Dyspnoe und Husten. Gelegentlich sind über längere Zeiträumeunspezifische Symptome wie Inappetenz, Leistungsschwäche und Apathie zu beobachten (NAGEL2000)
2.1.5 Bildgebende Diagnostik
Frühe röntgenologische Kennzeichen eines Osteosarkoms sind schlecht umschriebene, endostaleRegionen mit erhöhter oder erniedrigter Knochendichte. Später zeigen Osteosarkome meist eintypisch gemischt osteolytisch-osteoproliferatives Bild mit periostalen Knochenspikulationen. Dieosteolytische beziehungsweise osteoproliferative Komponente kann zu sehr unterschiedlichenAnteilen vertreten sein (OWEN 1962). Die Anhebung des Periosts durch neu gebildeten Knochenim Bereich der Läsionen kann zur Ausbildung des charakteristischen "Codman'schen Dreiecks"führen (JONGEWARD 1985, LING et al. 1974, SUTER 1963, WOLVEKAMP 1979). Dieses istjedoch nicht pathognomonisch für ein Osteosarkom. Starke periostale Reaktionen und vom Tumorproduziertes Osteoid formieren sich als von der Kompakta senkrecht vorstehende Spiculae, wasaufgrund des sonnenstrahlenartigen Aussehens auch als „Sunburst-Phänomen“ bezeichnet wird.
In vielen Fällen entsteht eine lokale Weichteilschwellung, in der mineralisierte Herde
vorzufindensein können. Die Grenze zwischen gesundem und tumorösem Gewebe ist häufig unscharf.
Nichtalle Osteosarkome präsentieren sich mit einem derart typischen Erscheinungsbild. GIBBS
undMitarbeiter (1984) fanden bei 17 % der untersuchten Osteosarkome atypische
röntgenologischeVeränderungen, zum Beispiel rein lytische Bilder, die mit Knochenzysten
verwechselt werdenkönnen.
Neben Röntgenbildern der Gliedmaße in zwei Ebenen sollte im Zuge der Stadieneinteilung
auchimmer die Lunge in zwei bis drei Ebenen geröntgt werden. Bei Verdacht auf weitere
Knochenläsionen sind Skelettübersichtsaufnahmen anzufertigen. Durch Skelettübersichtsaufnahmen (lateraleAufnahmen von allen Knochen) konnten in sechs bis sieben Prozent der untersuchten HundeKnochenmetastasen nachgewiesen werden (LARUE et al. 1986, STRAW et al. 1989)
Die Knochenszintigraphie ist geeignet, um die Ausdehnung der Läsion zu bestimmen und
möglicheKnochenmetastasen zu detektieren. Während bei den Röntgenuntersuchungen die
Knochenausdehnung zum Teil unterschätzt wird, kommt es bei der Szintigraphie in der Regel zur Überschätzungder Längenausdehnung, was sicherere Resektionsränder für gliedmaßenerhaltende Operationenliefert (LAMB et al. 1990, LEIBMANN et al. 2001). Die Untersuchung per Szintigraphie, sofernverfügbar, ist im Vergleich zur lateralen Übersichtsröntgenaufnahme aller Knochen zur Metastasensuche
sensitiver, weniger arbeitsintensiv, schneller und zumeist preisgünstiger. 99mTechnetiummethylen-Diphosphonat (99mTc-MDP)
ist ein Radionuklid, das an Hydroxyapatitkristalle bindet undunspezifisch Stellen mit
verändertem Knochenmetabolismus markiert. Da solche Veränderungendurch Tumor, Trauma oder
Entzündungen verursacht sein können (PARCHMAN et al. 1989), ist esper Szintigraphie nicht
möglich, zwischen benignen und malignen Knochenveränderungen zuunterscheiden. Es werden aber
Läsionen darstellbar gemacht, die auf Übersichtsaufnahmenunerkannt geblieben wären (BERG et al.
1990). Lungenmetastasen sind per Szintigraphie eherschlecht darstellbar (BERG et al. 1990). Da
multizentrische Osteosarkome oder Knochenmetastasenzum Zeitpunkt der Erstdiagnose selten
vorkommen, ist es nicht unbedingt notwendig, im Rahmenjeder Stadieneinteilung eine Szintigraphie
durchzuführen.
Einige Studien haben den Einsatz von Immunoszintigraphie zur Detektion von primären
undmetastatischen caninen Osteosarkomen untersucht. Dabei kamen radioiodinierte
F(ab`)2-Fragmentedes monoklonalen TP-1 Antikörpers zur Anwendung. Mikrometastasen kleiner als
fünf mmkonnten jedoch auch mit diesem Verfahren nicht nachgewiesen werden (HAINES et al.
1989,HAINES et al.1992). In einer anderen Studie an Hunden konnte eine erhöhte Menge an
18Fmarkierten Fragmenten von TP-3 sowohl im Primärtumor als auch in den Metastasen per PET-Scannachgewiesen werden (PAGE et al. 1994).
Computertomographische Untersuchungen lassen gute Aussagen über das Ausmaß der
Knochenveränderung und der Weichteilbeteiligung der Umgebung zu. Die Computertomographie (CT) istvor allem im Bereich von Wirbelkörpern, Schädel und Becken vorteilhaft. In diesen Regionen desSkeletts ist häufig die Aussagekraft klinischer und röntgenologischer Untersuchungen eingeschränkt
(MATTHIESEN et al. 1992). Die CT ist auch zum Nachweis möglicher Lungenmetastasensensitiver als
Röntgenbilder. Läsionen kleiner als fünf mm konnten jedoch auch in dieser Untersuchungsmethode in der Regel nicht dargestellt werden. Gelegentlich wurden falsch positive Befundeerhoben (COAKLEY et al. 1997, WATERS et al. 1998). Es gab keinen signifikanten Unterschiedzwischen computertomographischen Studien mit oder ohne arretierte Atmung (COAKLEY et al.1997).
Die Untersuchung caniner Osteosarkome durch Magnetresonanztomographie (MRT) wird in
derveterinärmedizinischen Literatur noch relativ selten beschrieben. Die MRT kann bei der
Untersuchung des lokalen Ausmaßes von Osteosarkomen nützlich sein (O´BRIEN et al. 1993, PICCI 1992,SCHIMA et al. 1994, VANHOENACKER et al. 2001, WALLACK et al. 2002). Dies ist vor allembei der Planung von gliedmaßenerhaltenden chirurgischen Eingriffen von besonderer Bedeutung.Hier ist die akkurate Planung der Resektionsebenen für den Erfolg des Eingriffes von entscheidender
Bedeutung, um dem Wachstum von lokalen Rezidiven vorzubeugen. DAVIS und Mitarbeiter(2002)
verglichen die Aussagekraft von Röntgen, CT und MRT bezüglich der Tumorlängenausdehnung von appendikularen Osteosarkomen. Die MRT-Untersuchungen waren zwar am wenigstenakkurat, führten aber in keinem der Fälle zur Unterschätzung der Längenausdehnung.
2.1.6 Biopsie
Eine definitive Bestätigung der klinisch und röntgenologisch begründeten Verdachtsdiagnoseerreicht man mit einer Gewebeprobe. Ohne zytologische oder histologische Bestätigung sind andereprimäre Knochentumoren nicht mit absoluter Sicherheit von Osteosarkomen zu unterscheiden(KNECHT und PRIESTER 1978, LIU et al. 1977, LLOYD et al. 1994). Auch Knochenmetastasenkönnen in ihrem Erscheinungsbild einem Osteosarkom ähnlich sein (BRODEY et al. 1966, LIU etal. 1977, OWEN 1962). Biopsien können offen per Inzision oder geschlossen per Trepan oderJamshidi-Nadel entnommen werden.
Anzahl und Lokalisation der Biopsien korrelieren eng mit der Wahrscheinlichkeit, eine
aussagekräftige Probe zu gewinnen. Diagnostisch ist es sicherer, das Zentrum des Tumors zu biopsieren als diePeripherie (diagnostische Sicherheit 83,9 % versus 54,5 %). Bei Probenentnahme aus beidenLokalisationen werden 92,3 % der Läsionen korrekt diagnostiziert (POWERS et al. 1988, WYKES1985). Biopsien aus Osteosarkomen sind nicht problemlos, da es zum einen zur weiteren statischenSchwächung des Knochens, zum anderen zur Tumorausbreitung entlang des Biopsiekanals kommenkann. Weniger aufwändig und invasiv ist die zytologische Diagnostik per Feinnadelaspiration.Besonders bei lytischen Läsionen sind zum Teil recht einfach Zellen zu gewinnen (BRITT et al.2007, SAMII et al. 1999, STOCKHAUS et al. 2003). Auf diese Weise können andere Gründe fürosteolytische Läsionen, wie zum Beispiel bakterielle oder mykotische Osteomyelitiden, relativsicher ausgeschlossen werden.
2.1.7 Einteilung in StadienZur Stadieneinteilung sind Röntgenbilder der Gliedmaße sowie der Lunge, eine sorgfältige Palpation und
gegebenenfalls eine Biopsie (Aspiration) der tributären Lymphknoten ratsam. Metastasensind in
der Regel als Rundherde ab einem Durchmesser von fünf bis zehn mm vor allem in derPeripherie der
Lunge sichtbar. Skelettübersichtsaufnahmen und szintigraphische Darstellungen sindzur Detektion
von sekundären Knochenläsionen geeignet.
Routineuntersuchungen sollten zudem die Nierenfunktion (STRAW et al. 1990) und
Serum-APumfassen (EHRHART et al. 1998, GARZOTTO et al. 2000, KIRPENSTEIJN et al. 2002).
DieNierenfunktion ist bedeutsam für die Auswahl der geeigneten adjuvanten Chemotherapie.
DieSerum-AP hat prognostische Relevanz für die Überlebenszeit nach einer Therapie mit
kurativerIntention.
Die TNM-Klassifizierung und Stadieneinteilung der WHO für canine und feline
Knochentumorenist in Abbildung 1 beschrieben. Sie ist auf eine TM-Klassifizierung reduziert, da
regionale Lymphknotenmetastasen sehr selten auftreten. Bei der Erstvorstellung befinden sich die meisten Patientenin Stadium II, das heißt der Tumor ist makroskopisch auf die Primärlokalisation beschränkt,überschreitet aber den Markraum (ENNEKING et al. 1986, STRAW et al. 1990).
TM-Klassifizierung und Stadieneinteilung der WHO für canine und feline
Knochentumoren
T: Primärtumor
T0 kein Tumor sichtbar
T1 Tumor innerhalb Medulla und Cortex
T2
Tumorausdehnung über das Periost hinausMultiple Tumoren sollten unabhängig klassifiziert
werden.
M: Fernmetastasen
M0 keine Fernmetastasen ersichtlich
M1
Fernmetastasen nachweisbar (spezifische(r) Metastasierungsort(e))
Stadium
I Primäres Osteosarkom innerhalb von Medulla und Kortex des Knochens
II Osteosarkom über die periostalen Grenzen hinaus reichend, ohne Weichteilreaktion
III Osteosarkom über die periostalen Grenzen hinaus reichend, mit Weichteilreaktion
IV
Metastasen präsenta) keine allgemeinen Krankheitsanzeichenb) mit allgemeinen Krankheitsanzeichen
2.1.8 PathologieDefinitionsgemäß sind Osteosarkome maligne mesenchymale Tumoren, die durch die Produktionvon Knochengrundsubstanz (Osteoid), immaturem Knochen oder beidem durch die Tumorzellencharakterisiert sind (GOORIN et al. 1985, KIRPENSTEIJN et al. 2002, MISDORP und HART1979). Anhand der Menge der produzierten Matrix und der Anordnung der Zellen teilt manOsteosarkome in morphologische Subklassen ein: osteoblastisch, fibroblastisch, chondroblastisch,teleangiektatisch und undifferenziert (GLEISER et al. 1981, GOORIN et al. 1985, MAHAFFEY1985, MISDORP und HART 1979).
Die
histologischen Kennzeichen variieren bei Osteosarkomen stark zwischen den einzelnenTumoren und
sogar innerhalb des gleichen Tumors. Man kann häufig multiple Subtypen sowieUnterschiede in der
Zellmorphologie und Matrix innerhalb eines Tumors nachweisen (GLEISER etal. 1981, MISDORP und
HART 1979). Dies ist wahrscheinlich der Grund dafür, dass die Subklassifizierung bei humanen und caninen Osteosarkomen bisher nicht zu prognostisch signifikantenUnterschieden geführt hat (GRUNDMANN et al. 1995, KIRPENSTEIJN et al. 2002, WATERS etal. 1997).
Die histologische Gradeinteilung des Tumors hingegen dient als Indikator für die Prognose
voncaninen Osteosarkomen und kann als Kriterium für Therapieentscheidungen herangezogen
werden(GRUNDMANN et al. 1995, KIRPENSTEIJN et al. 2002, LOUKOPOULOS und ROBINSON2007). Diese Ergebnisse widersprechen früheren Berichten, denen zufolge der histologische Gradvon Osteosarkomen keinen prognostischen Wert hat (HAMMER et al. 1995, MISDORP et al. 1971,STRAW et al. 1996). Mit Hilfe eines neuen, standardisierten Klassifizierungsschemas wurden 75 %der Osteosarkome als Grad III, 21 % als Grad II und 4 % als Grad I eingeteilt (KIRPENSTEIJN etal. 2002).

Auch die Flußzytometrie kann zur Kategorisierung von caninen Osteosarkomen benutzt
werden.Ursprünglich ging man davon aus, dass Osteosarkome meist hypoploid sind (POOL und
WOLF1974). Eine Studie von FOX und Mitarbeitern (1990) ergab jedoch bei 25 von 48 (52 %)
primärenOsteosarkomen Aneuploidie, wobei fünf von diesen 25 hypoploid und 20 hyperploid
waren.MULLINS und Mitarbeiter (2004) zeigten bei 77,3 % von 44 analysierten Osteosarkomen
COX-2-Expression. Hunde mit starker COX-2-Expression hatten signifikant kürzere
Überlebenszeiten.
2.1.9 Therapie und Prognose
Man unterscheidet im Wesentlichen zwei große Therapiegruppen. Aufgrund der hohen Wahrscheinlichkeit einer
Metastasierung zum Zeitpunkt der Diagnose ist keine Heilung des Patienten zuerwarten. Bei einer
Therapie mit „kurativer“ Intention wird der Primärtumor durch Amputationoder
gliedmaßenerhaltenden Techniken entfernt und eine adjuvante Chemotherapie angeschlossen.Ist das
Ziel eine Palliation, das heißt Schmerzlinderung und Funktionsverbesserung der Gliedmaße,sind
eine lokale Bestrahlung oder die Gabe von Analgetika wirksame Alternativen.
Es gibt
zudem verschiedene Perspektiven, mit denen man eventuell die Behandlungserfolgeverbessern
könnte. Dazu gehören Immunotherapie, die sich zwar schon als wirksam erwiesen hat,aber zur Zeit
nicht verfügbar ist, Bisphosphonate, metronomische Chemotherapie und die Kombination von Bestrahlung mit verschiedenen anderen Therapieansätzen. Auf die Bestrahlungstherapiewird in Kapitel 2.2 eingegangen.
2.1.9.1 Amputation
Die Amputation stellt beim caninen appendikularen Osteosarkom die am häufigsten beschriebeneTherapiemodalität dar. Sie ist in Kombination mit einer adjuvanten Chemotherapie derzeit Therapieder Wahl. Die Resektionsebene ist von der Tumorlokalisation abhängig (KIRPENSTEIJN 2004,NAGEL 2000). Einer Amputation stehen häufig Bedenken seitens der Besitzer oder auch orthopä-dische und neurologische Probleme des Patienten entgegen. Zwei Studien belegen, dass dieLebensqualität und die Lauffähigkeit auch bei großen Hunden nach einer Gliedmaßenamputation inder Regel exzellent sind (CARBERRY und HARVEY 1987, KIRPENSTEIJN et al. 1999). DerGroßteil der Patienten lernt das Laufen auf drei Beinen innerhalb eines Monats. Es besteht keinesignifikante Abhängigkeit zwischen der Adaptionszeit und einer Vorder- versus Hintergliedmaßenamputation, beziehungsweise dem Alter oder der Körpermasse des Patienten (CARBERRY undHARVEY 1987, WITHROW und HIRSCH 1979).
Dennoch
wird durch eine Gliedmaßenamputation das Belastungsmuster jeder einzelnen Gliedmaßesignifikant
verändert. Hunde mit fehlender Vordergliedmaße müssen ihr Gangmuster stärker denGegebenheiten
anpassen als solche, bei denen ein Hinterbein amputiert wird. Auch kommt es beieiner
Vordergliedmaßenamputation zu einer stärkeren Belastung der kontralateralen Gliedmaße imVergleich zu der Last, die das andere Hinterbein bei Hintergliedmaßenamputation zu tragen hat.Diese Unterschiede verlieren im Lauf der Zeit nach der Operation an Bedeutung (BUDSBERG etal. 1987, KIRPENSTEIJN et al. 2000).
2.1.9.2 Gliedmaßenerhaltende Techniken
Bei einem Tumor im Bereich der distalen Radius- und/oder Ulnametaphyse (LASCELLES et al.2005, STRAW et al. 1991), der Skapula (KIRPENSTEIJN et al. 1994, NORTON et al. 2006,TROUT et al. 1995), proximal im Femur (LIPTAK et al. 2005), der Zehen (GAMBLIN et al. 1995)und in diaphysärer Lokalisation (LIPTAK et al. 2004) sind erfolgreiche gliedmaßenerhaltendeTumorresektionen durchgeführt worden („limb-sparing"). Das entfernte Knochensegment wirddurch Spenderknochen (tiefgeforenes Allograft aus einer Spenderbank) oder Knochenzementersetzt. Es gibt auch Verfahren, bei denen der betroffene Knochenabschnitt entfernt und nachextrakorporaler Bestrahlung oder Pasteurisierung wieder reimplantiert wird (MORELLO et al.2003). Der Spenderknochen, eigene Knochen oder auch der Knochenzement werden mit Hilfe einerVerbundosteosynthese an den proximalen und distalen Gliedmaßenabschnitten fixiert. Die Ergebnisse für Osteosarkome proximal im Humerus (KUNTZ et al. 1998), distal im Femur und in derTibia (STRAW et al. 1990) sind nicht ermutigend. So beobachteten KUNTZ und Mitarbeiter (1998)nur bei 12 % der Patienten gute Erfolge bei gliedmaßenerhaltenden Techniken.
Zwei
Studien zeigten vergleichbare Überlebenszeiten bei Amputationen mit adjuvanter Chemotherapie versus „limb-sparing“-Operationen mit Chemotherapie (DERNELL et al. 2001, STRAW undWITHROW 1996). Die lokale Rezidivrate liegt mit 22-25 % zwar deutlich höher als bei Amputationen, jedoch
wird bei korrekter Behandlung die Überlebenszeit dadurch nicht negativ beeinträchtigt(DERNELL et
al. 2001, STRAW und WITHROW 1996).
Voraussetzungen für eine solche extremitätenerhaltende Therapie sind neben der geeignetenLokalisation, dass der Tumor röntgenologisch weniger als 50 % der Längenausdehnung desKnochens einnimmt und keine starke Weichteilinvasion stattgefunden hat. Bei korrekt ausgewähltem Patientengut und entsprechender Erfahrung des Chirurgen können bis zu 90 % der Patientengute bis hervorragende Gliedmaßenfunktion erreichen (STRAW und WITHROW 1996). Die „limbsparing"-Verfahren sind sehr aufwändig und mit einer erheblichen Komplikationsrate behaftet.
Als
Komplikationen treten lokale Rezidive und Infektionen von Allograft, Knochen und/oderWeichteilgewebe, Resorption des Spenderknochens, Lockerung des Implantats, Frakturen vonKnochen oder Platte und Wundheilungsstörungen auf (DERNELL et al. 2001, LARUE et al. 1989,MORELLO et al. 2001, STRAW und WITHROW 1996). Die komplette Resorption des Spenderknochens und dessen
körpereigener bindegewebiger Ersatz kann mehr als fünf Jahre dauern(WILSON und HOEFLE
1990).
Komplikationen durch Lockerung des Implantats und Versagen der Fixation nehmen signifikant
anHäufigkeit ab, wenn Knochenzement in den Knochenmarkraum des Allografts eingebracht
wird(KIRPENSTEIJN et al. 1998). Alternativen zum gefrorenen Spenderknochen sind, wie oben
schonerwähnt, extrakorporale Bestrahlung (DERNELL et al. 2001) oder Pasteurisierung (BURACCO
etal. 2002) des tumortragenden Knochensegments, Transposition eines Ulnaautografts (JEHN et
al.2007, SEGUIN et al. 2003) oder Knochentranspositionstechniken nach Ilizarov (ROVESTI et
al.2002).
2.1.9.3 Chemotherapie
Die Prognose von Menschen und Hunden mit Osteosarkomen hat sich mit dem Einsatz vonzytostatischen Chemotherapeutika entscheidend verbessert. Es wurden zahlreiche Chemotherapeutika und Protokolle eingesetzt und evaluiert. Aufgrund der sehr hohen Metastasierungsneigung sindbei alleiniger Amputation lediglich Überlebenszeiten von median 18-19 Wochen zu erwarten. Nuretwa 10 % der Patienten leben länger als ein Jahr (BRODEY und ABT 1976, SPODNICK et al.1992). Ganz vereinzelt gibt es Berichte über Spontanregressionen von Knochentumoren und ihrenMetastasen (FOXELL 1996, MEHL et al. 2001). Um eine zügige Manifestierung der Metastasen zuverhindern, ist nach einer Amputation oder einem „limb-sparing" eine adjuvante Chemotherapieunabdingbar.
In Abwägung, einerseits möglichst früh mit einer Chemotherapie zu beginnen, und andererseits demPatienten nach der Operation etwas Zeit zur Regeneration und Anpassung an die neue Situation zugeben, sollte etwa eine Woche nach Amputation mit der adjuvanten Therapie begonnen werden(BERG 1996, BERG et al. 1997). Am häufigsten kommen Platinderivate (Carboplatin, Cisplatin)mit zwei bis sechs Behandlungen alle drei bis vier Wochen oder Doxorubicin mit fünf Behandlungen alle zwei bis drei Wochen oder eine Kombination aus den oben genannten Medikamenten zumEinsatz. Alle diese Medikamente werden intravenös verabreicht. Auch andere Chemotherapeutika,wie zum Beispiel Methotrexat (COTTER und PARKER 1978) und Dexnigulpidine (HAHN et al.1997), sind zur adjuvanten Therapie von Osteosarkomen getestet worden. Sie haben sich jedochnicht als ausreichend wirksam erwiesen.
Standardprotokolle umfassen vier i.v.-Applikationen von Cisplatin mit einer Dosis von70 mg/m2
KOF (Körperoberfläche) alle drei Wochen jeweils mit einem Diureseprotokoll von vierbis sechs Stunden (OGILVIE et al. 1993, SHAPIRO et al. 1988). Die intraarterielle Applikation
vonCisplatin verursacht signifikante Tumornekrosen. Dieser aufwändigere Applikationsweg ist
jedochim Vergleich zur intravenösen Administration nicht mit längeren Überlebenszeiten
verbunden(WITHROW et al. 1990).
Auch andere Applikationswege wie intrakavitär (MOORE et al. 1991), intramedullär (HAHN et al.1996), subkutan (DERNELL et al. 1997), per regionaler Perfusion (HOEKSTRA et al. 1993, VANGINKEL et al. 1995) und lokal in einer slow-release Form (WITHROW et al. 1995) sind beschrieben worden. Die subkutane Anwendung kann wegen schwerer Nebenwirkung nicht empfohlenwerden (DERNELL et al. 1997). Der Einsatz von lokal langsam freigesetzten Chemotherapeutika(OPLA-Pt, ein open-cell lactic acid polymer imprägniert mit Cisplatin) kann die Inzidenz vonTumorrezidiven und die Metastasierung nach gliedmaßenerhaltender Chirurgie senken (DERNELLet al. 2001, WITHROW et al. 2004).
OWEN und
Mitarbeiter haben 1961 die erste isolierte, regionale Gliedmaßenperfusion bei einemHund mit
bilateralem Osteosarkom distal im Radius durchgeführt. Die Perfusion mit NitrogenMustard
resultierte in einer Überlebenszeit von 61 Tagen. Bei 28 Hunden wurde die lokale Perfusion von Cisplatin mit Hyperthermie kombiniert, neun Hunde therapierte man nur mit lokalerCisplatinperfusion. Es konnte durch die Kombination ein erhöhtes Ausmaß an Tumornekrose undeine verzögerte lokale Tumorprogression erreicht werden. Sie war jedoch ohne systemischenmetastasenhemmenden Effekt und verbunden mit einer relativ hohen postoperativen Todesrate(HOEKSTRA et al. 1993, VAN GINKEL et al. 1995).
Carboplatin, ein Platinderivat der zweiten Generation, wurde bei 48 Hunden mit
appendikularenOsteosarkomen nach Gliedmaßenamputation in einer Dosis von 300 mg/m2 KOF
viermal alle dreiWochen eingesetzt und gut vertragen (BERGMANN et al. 1996). Carboplatin hat im
Vergleich zuCisplatin den Vorteil, dass auf eine Diurese verzichtet werden kann und damit die
Applikationdeutlich einfacher ist. Aufgrund des geringeren Potenzials an Nephrotoxizität kann es
per Kurzinfusion über 20 Minuten appliziert werden (BERGMANN et al. 1996).
Obwohl frühe Berichte über den Einsatz von Doxorubicin bei caninen Osteosarkomen
nichtermutigend waren, erreichten BERG und Mitarbeiter (1995) ähnliche Ergebnisse wie bei
historischen Cisplatinkontrollen. Zwei Jahre später bewiesen sie (BERG et al. 1997), dass die frühepostoperative Gabe (zwei Tage post OP) von Doxorubicin und Cisplatin keine Vorteile gegenübereiner späteren Applikation bringt. Doxorubicin wird mit einer Dosis von 30 mg/m2 KOF alle
zweibis drei Wochen fünf- bis sechsmal über 20 Minuten streng i.v. infundiert.
BERG und Mitarbeiter (1997) kombinierten niedrig dosiertes Cisplatin und niedrig
dosiertesDoxorubicin am gleichen Tag und erzielten damit verbesserte Überlebenszeiten gegenüber
einerMonotherapie mit Cisplatin oder Doxorubicin für Hunde mit appendikularem Osteosarkom.
CHUNund Mitarbeiter (2000) applizierten am ersten Tag Cisplatin und am Folgetag Doxorubicin
underreichten damit ein krankheitsfreies Intervall von median 16 Monaten.
Der alternierende Einsatz von Cisplatin und Doxorubicin alle drei Wochen führte zu
medianenÜberlebenszeiten von 300 Tagen (CHUN et al. 2005). Die Kombination von Carboplatin
undDoxorubicin am Folgetag resultierte in krankheitsfreien Intervallen von nur sieben
Monaten(BAILEY et al. 2003). Wurde Carboplatin und Doxorubicin alternierend alle drei Wochen
nachAmputation oder „limb-sparing“ infundiert, so erreichten die Patienten 320 Tage mediane
Überlebenszeit (KENT et al. 2004).
2.1.9.4 Bisphosphonate
Die Gruppe der Bisphosphonate wird auch für den Einsatz in der Veterinärmedizin in zunehmendem Maße
interessant. Bisphosphonate verhindern die Knochenresorption durch Inhibition derOsteoklastenaktivität. Es werden Nichtamino- (Etidronate, Clodronate) und Aminobisphosphonate(Pamidronate, Alendronate, Risedronate, Zoledronate) unterschieden. Die Aminobisphosphonatestellen die neuere Medikamentengeneration dar und weisen größere antiresorptive Eigenschaftenauf (FAN et al. 2005, MILNER et al. 2004).
Bisphosphonate haben neben der Hemmung der Osteoklastenaktivität auch direkte Effekte
aufTumorzellen. Sie induzieren die Apoptose (FROMIGUE et al. 2000, SENARATNE et al. 2002)
undhemmen die Angiogenese (FOURNIER et al. 2002, SANTINI et al. 2002, WOOD et al.
2002).Zudem reduzieren sie die Tumorzelladhäsion an der Knochenmatrix und die
Tumorzellproliferation, stimulieren die γ- und δ-T-Zellen (SANTINI et al. 2002) und inhibieren Matrixmetalloproteinasen (HEIKKILA et al. 2002, TERONEN et al. 1999). Des Weiteren beeinflussen sie
auch Zytokineund Wachtstumsfaktoren und verhalten sich immunmodulatorisch. Pamidronate und auch
andereBisphosphonate inhibieren in vitro nachweislich das Wachstum von Osteosarkomzellen
(ASHTONet al. 2005, ENDO et al. 1996, FARESE et al. 2004, FRITH et al. 1997, KLENNER et al.
1990,MACKIE et al. 2001, POOL et al. 1988, SONNEMANN et al. 2001). Die Studien von NEVILLEWEBBE
und Mitarbeitern (2002) und GREEN (2003) zeigten einen synergistischen Effekt vonBisphosphonaten
und Medikamenten wie Doxorubicin, Dexamethason und Cyclooxygenase-2-Inhibitoren.
SANTINI und Mitarbeiter (2002) zeigten, dass Pamidronate-Infusionen die VEGF
(vascularendothelial growth factor)-Konzentrationen für sieben Tage signifikant senken. VEGF ist
einunabhängiger prognostischer Faktor für verschiedene maligne Tumoren und ist für die
Vorhersagedes Therapieerfolges nützlich. Klinische onkologische Anwendungsbereiche für
Bisphosphonatesind maligne Hyperkalzämie, Inhibition von Knochenmetastasen und Behandlung von
tumorbedingtem Knochenschmerz (GREEN 2003).
Bisher ist relativ wenig über die klinische Wirkung von Bisphosphonaten bei caninen Tumorenpubliziert. Die Studien von CHEW und Mitarbeitern (2003) und VASILOPULOS und MACKIN(2003) beschreiben die Anwendung bei caniner maligner Hyperkalzämie.
FAN und
DE LORIMIER (2003) befassten sich mit den molekularen Mechanismen und therapeutischen Möglichkeiten in der Veterinäronkologie. TOMLIN und Mitarbeiter (2000) verabreichtenAlendronate bei einem Hund mit einem Osteosarkom der Tibia und einem Patienten mit einemOsteosarkom des Jochbogens. Bei beiden Hunden wurde eine Schmerzlinderung erreicht. Sie lebtenzudem ohne Tumorentfernung verglichen mit den entsprechenden Literaturangaben länger alserwartet. FAN und Mitarbeiter (2007) infundierten Pamidronate bei 43 Hunden mit appendikularemOsteosarkom. Zwölf der 43 Patienten erfuhren signifikante Schmerzlinderung durch diese Behandlung.
2.1.9.5 Analgetika
Palliative Therapien sind auf die Behandlung des Tumorschmerzes und damit auf die Verbesserungder Lebensqualität ausgerichtet. Eine systemische Schmerztherapie beim Osteosarkom des Hundesmit den in der Tiermedizin zugelassenen Schmerzmitteln ist nur in der Frühphase der Erkrankungerfolgreich. Die mediane Überlebenszeit liegt bei ein bis drei Monaten (BRODEY et al. 1976). BeiFortschreiten der tumorbedingten Osteolyse zeigt selbst der Einsatz von Morphin-Derivaten (zumBeispiel transdermale Fentanyl-Applikationssysteme) nur eine unzureichende Schmerzlinderung,was sich in einer mangelhaften oder fehlenden Gliedmaßenbelastung, Muskelatrophie und deutlichen Reduktion der Lebensqualität äußert.
Werden
bei Patienten, bei denen aus medizinischen oder persönlichen Erwägungen keine Gliedma-ßenamputation (beziehungsweise „limb-sparing“) in Frage kommt, keine stärkeren palliativenMaßnahmen eingeleitet, kommt es in der Regel aufgrund unstillbarer Tumorschmerzen innerhalbweniger Wochen nach Diagnosestellung zur Notwendigkeit der Euthanasie.
2.1.9.6 Prognose
Die Prognose bei humanen und caninen Osteosarkompatienten ist abgesehen von der Wahl derTherapie von verschiedenen weiteren Variablen abhängig. Die folgende Abbildung gibt einenÜberblick über prognostische Variablen beim caninen Osteosarkom bezogen auf eine chirurgischeTherapie (Amputation oder gliedmaßenerhaltende Chirurgie) mit adjuvanter Chemotherapie(KIRPENSTEIJN 2004).

Prognostische Variablen für Hunde mit Osteosarkom bei chirurgischer Therapie
(Amputation oder „limb-sparing“) und adjuvanter Chemotherapie
2.2 Strahlentherapie
2.2.1 Allgemeines zur Bestrahlung
Die
Strahlentherapie ist ein wichtiger, bisher in Europa in vielen Regionen nur unzureichendverfügbarer Bestandteil der Krebstherapie von Kleintieren. Ihre Anwendung kann im Wesentlichenin vier große Disziplinen eingeteilt werden: 1) primäre Strahlentherapie, 2) adjuvante
Bestrahlung,3) neoadjuvante Bestrahlung und 4) palliative Bestrahlung.
Bei einer primären Strahlentherapie werden die hochenergetischen Strahlen alleine zur
Behandlungvon invasiven, nicht resezierbaren Tumoren eingesetzt, vorausgesetzt der Tumor ist
strahlensensitiv. Ihr Einsatzgebiet liegt vor allem bei Tumoren der Nasenhöhle und bei Gehirntumoren. Bei deradjuvanten Bestrahlung wird das Tumorbett optimalerweise kurz nach dem chirurgischen Eingriffbestrahlt, um verbleibende Tumorzellen abzutöten. Dies ist bei zahlreichen Tumorerkrankungenmöglich und kommt vorwiegend bei invasiven Tumoren (zum Beispiel Fibrosarkome, Mastzelltumoren, etc.) in
Problemlokalisationen (Kopf, Gliedmaßen) in Frage, da dort eine genügend weitechirurgische
Exzision vielfach nicht möglich ist.
Bei einer neoadjuvanten Bestrahlung wird der Tumor vor der chirurgischen Therapie bestrahlt.
Zielist, die Tumorränder zu sterilisieren, in manchen Fällen den Tumor präoperativ zu
verkleinern unddie Vaskularisation im Tumorbereich zu verändern (KASER-HOTZ et al. 1994).
Hauptziel derpalliativen Bestrahlung ist es, durch den Tumor verursachte Symptome, vor allem
Schmerz, zulindern und den Zustand des Patienten zu stabilisieren. In einigen Fällen kann auch
die Funktion desbetroffenen Organs oder Körperteils verbessert werden (KASER-HOTZ et al.
1994).
2.2.2 Physikalische Grundlagen
Ionisierende Strahlung kann genutzt werden, um Tumorzellen abzutöten. Ionisierung (Verlust einesElektrons) verursacht Zellschäden, deren Resultat in letzter Konsequenz der Zelltod ist.
Photonensind Quanten an Energie ohne Masse oder Ladung. Röntgenstrahlen sind Photonen, die
durchextranukleare Interaktionen, wie bei Röntgengeräten und Linearbeschleunigern, erzeugt
werden.Dies geschieht beim Auftreffen beschleunigter Elektronen auf ein Target (meist
Metall).
Gammastrahlen sind ebenfalls Photonen. Diese entstehen jedoch durch intranuklearen Zerfall
vonunstabilen (radioaktiven) Elementen wie zum Beispiel Cobalt 60 und Cäsium 137. Da
PhotonenMaterie durchdringen können, kommt es zur Interaktion mit dem bestrahlten Gewebe.
Energie wirdauf das Gewebe übertragen, wodurch Elektronen in Bewegung gesetzt werden und
zusätzlich zurIonisierung und Anregung führen. Dies macht sich dann als Streustrahlung
bemerkbar. DieInteraktionen mit dem Gewebe manifestieren sich verschiedentlich im Photoeffekt,
Comptoneffektund der Paarbildung.
Der Photoeffekt resultiert in der vollständigen Absorption eines Photons durch ein Elektron
einerinneren Schale, welches dadurch herausgeschleudert wird. Die Wahrscheinlichkeit für das
Auftretendes Photoeffektes ist proportional zu Z3/E3
(Z=Ordnungszahl des bestrahlten Atomkerns, E=Energiedes auftreffenden Photons). Im Fall von Strahlen niedriger Energie (zum Beispiel Orthovoltage)
istdie Absorption durch Gewebe mit hoher Z wie Knochen viel höher als die durch das
umgebendeWeichteilgewebe mit niedriger Z. Im Bereich von Megavoltagestrahlen ist die
Wahrscheinlichkeitfür den Photoeffekt deutlich geringer. Dadurch kommt es zu einer homogeneren
Verteilung derEnergie im Gewebe. Dies verhindert zum einen das Abschirmen von Tumoranteilen
durch benachbarten Knochen, zum anderen wird das Auftreten von Osteoradionekrose erheblich gesenkt.

Photoeffekt (nach NÜSSLIN 1998)
Der Comptoneffekt ist der Effekt, der im Bereich der gängigen Megavoltagetherapiegeräte
dominiert. Hier wird durch das Photon ein Elektron einer äußeren Schale herausgelöst, welches hochenergetisch ist und sich vor allem in Vorwärtsrichtung bewegt. Aus therapeutischer Sicht ergibt
sichdaraus mit steigender Energie der Photonen ein zunehmender hautschonender Effekt. Dies
giltjedoch nicht bei der Bestrahlung mit Elektronen statt Photonen.

Comptoneffekt (nach NÜSSLIN 1998)
Der Paarbildungseffekt spielt nur bei hohen Photonenenergien eine bedeutsame Rolle. Durch
dasankommende Photon wird in Kernnähe aus Energie Materie (ein Elektron und ein Positron)
erzeugt.

Paarbildungseffekt (nach NÜSSLIN 1998)
Als Resultat dieser Interaktionen vermindert sich die Photonenenergie auf dem Weg durch
dasbestrahlte Gewebe. Strahlen mit hoher Energie werden weniger geschwächt und können deshalb
zurBestrahlung von tiefer gelegenen Tumoren benutzt werden. Die Strahlen der
verschiedenenTherapiegeräte erzeugen entsprechende Tiefendosiskurven, die die Dosis in Prozent
entlang derBestrahlungsachse wiedergeben.

Tiefendosiskurven für verschiedene Strahlenarten und Energien
(nach RICHTER UND SCHWAB 1998):
e-=Elektronenstrahlen der Energie 10 MeV,
n=Neutronenstrahlung der Energie 15 MeV,
p=Protonen der Energie 187 MeV,
kV=Kilovolt, MV=Megavolt,
MeV=Megaelektronenvolt
Es gibt verschiedene Parameter, die die Tiefendosiskurven beeinflussen. Dies sind die
Strahlenart(Photonen, Elektronen, Protonen), deren Energie, die Feldgröße und der
Fokus-Haut-Abstand(LINDER und KNESCHAUREK 1996). Photonenstrahlung niedriger Energie erreicht
ihr Dosismaximum auf der Hautoberfläche. Mit zunehmender Energie befindet sich das Dosismaximumaufgrund des Dosisaufbaueffektes immer weiter in der Tiefe. Für Elektronen zeigt die Tiefendosiskurve ein
schwach ausgeprägtes Maximum und fällt in der Tiefe rasch ab. Protonen haben in derTiefe einen
steilen Dosisanstieg und -abfall auf Null. Die Strahlungsintensität vermindert sich mitdem
Quadrat des Abstands von der Quelle im Nenner, bekannt als Abstandquadratgesetz.
2.2.3 Cobalt60-Teletherapie
Cobalt60-Geräte gehören wie auch die Linear- oder Kreisbahnbeschleuniger zu den Megavoltagegeräten. Diese werden von den Orthovoltagegeräten unterschieden, die mit Strahlen niedriger Energie(250-500 kV) arbeiten. Bei Cobalt60-Teletherapieeinheiten macht man sich den Zerfall von radioaktivem Cobalt60 zu Nickel zunutze. Dabei werden Gammastrahlen mit Energien von 1,17 und1,33 MeV, durchschnittlich 1,25 MeV, emittiert. Die Cobaltquelle im gut abgeschirmten Kopf desGerätes zerfällt kontinuierlich mit einer Halbwertszeit von 5,26 Jahren. Die Strahlung wird durchBewegen der Quelle über einen offenen Port genutzt. Die Feldgröße kann durch den Kollimator aufdie gewünschte Dimension begrenzt werden. Man erzielt einen hautschonenden Effekt, da dasDosismaximum in 0,5 cm Tiefe liegt. Tiefer liegende Tumoren können behandelt werden, ohneinakzeptable Hautreaktionen hervorzurufen.
Ist es
erforderlich, dass auch die obersten Hautschichten Maximaldosis erhalten, muss man mitgewebeäquivalentem Material (Bolus) den Maximalpunkt um 0,5 cm nach oben verlagern. Esbesteht nur ein minimaler Unterschied in der Absorption der Strahlen durch Knochen und Weichteilgewebe.
Cobaltgeräte können in der Regel um ein Isozentrum im Patienten rotieren, wodurch dieBehandlung
über multiple Felder ermöglicht wird. Wenn die Dosisleistung durch den kontinuierlichen Zerfall zu niedrige Werte erreicht, muss die Quelle ausgetauscht werden. Da der Durchmesserder Quelle ein bis drei Zentimeter beträgt, hat man im Vergleich zu Linearbeschleunigern einenrecht großen Penumbra (=Halbschatten). Dieser muß in die Behandlungsplanung mit einkalkuliertwerden. Cobaltgeräte sind weitaus weniger anfällig gegenüber technischen Problemen als Linearbeschleuniger
(LINDNER und KNESCHAUREK 1996, SAUER 1998, SCHMIDT 1998).
2.2.4 Grundlagen der Strahlenbiologie
2.2.4.1 Mechanismen auf Zellebene
Durch
Radikalbildung kommt es vor allem zur Reaktion mit der Erbsubstanz der Zellen, der DNS,aber auch
mit den Proteinen der verschiedenen Zellanteile. An der DNS entstehen typische Schädenin Form
von Veränderungen der Basen und Polynukleotidketten. Man unterscheidet Einzel- undDoppelstrangbrüche, wobei vor allem die Doppelstrangbrüche für den nach Stunden bis Tageneintretenden Zelltod maßgeblich verantwortlich sind. Die Empfindlichkeit einer Zelle gegenüberStrahlung hängt unter anderem von der Zellzyklusphase ab, in der sie sich gerade befindet. Zellen
inder Mitose- und G2-Phase sind am empfindlichsten, während Zellen in der S-Phase am
strahlenresistentesten sind.

Phasen des Zellzyklus (nach LIEBICH 1990)
Neben der Zellzyklusphase spielt die Art des Ursprungsgewebes ebenfalls eine Rolle für dieStrahlenempfindlichkeit. Sich regelmäßig teilende Zellen werden vermehrt geschädigt, sie sterbenbeim Versuch der Zellteilung ab. Bei Geweben mit rascher Proliferation (zum Beispiel Haut,Mukosa, Knochenmark und die meisten Tumoren) werden daher innerhalb von wenigen Wochenakute Reaktionen beobachtet. Ab einer bestimmten Anzahl vernichteter Stammzellen verändert sichdurch mangelnde Regenerationsfähigkeit das gesamte betroffene Gewebe. Die Spätreaktionenlangsam oder nicht proliferierender Gewebe (zum Beispiel Nerven, Muskeln und Knochen) tretenerst nach Monaten oder Jahren auf (HAND et al. 2004).
2.2.4.2 Dosis-Wirkungs-Beziehung
Ionisierende Strahlung unterscheidet nicht zwischen normalen und tumorösen Zellen, wodurch eszu unerwünschten Wirkungen am gesunden Gewebe kommt. Um die Strahlentherapie optimal zugestalten, muss man maximale Wirkung am Tumor bei möglichst minimaler Schädigung desnormalen umgebenden Gewebes erreichen.
Die Dosis-Wirkungs-Kurve beschreibt sowohl die Wahrscheinlichkeit der Tumorvernichtung alsauch die Toleranz des gesunden Gewebes in Abhängigkeit von der Strahlendosis. Je weiter dieKurve der Tumorzerstörung von der Toleranzkurve des normalen Gewebes abweicht, umso höherist die Chance für eine Heilung oder Tumorkontrolle ohne größere Komplikationen (LINDER undKNESCHAUREK 1996, SAUER 1998, SCHERER und SACK 1989).
2.2.4.3 Fraktionierung
Appliziert man die Gesamtdosis nicht in einer, sondern in mehreren Portionen (Fraktionen), sobeobachtet man einen kleineren biologischen Effekt. Die Erklärung dafür liegt in den „4 R“ derStrahlentherapie (Reparation, Reoxygenierung, Repopulation, Redistribution) (WITHERS 1975).
Reparation: Für dieses Phänomen ist die große Kapazität von Säugerzellen, DNA-Schäden zureparieren, verantwortlich. Da die Fähigkeit zur Reparation bei gesunden Zellen größer ist als
beiTumorzellen, besteht hier ein therapeutischer Vorteil. Wenn multiple Fraktionen appliziert
werden,sterben mehr tumoröse als gesunde Zellen ab. Säugerzellen können durch Bestrahlung
entstandeneSchäden meist innerhalb von 24 Stunden reparieren (GILETTE und GILETTE 1995,
KASERHOTZ et al. 1994, LARUE und GILETTE 1996).
Reoxygenierung: Zwischen den einzelnen Fraktionen werden hypoxische Tumorzellen wieder mitSauerstoff versorgt. Diese Reoxygenierung erhöht die Strahlenempfindlichkeit, da sauerstoffarmeZellen strahlenresistenter sind. Sterben Zellen durch die Bestrahlung ab, verbessert sich dieSauerstoffversorgung der verbliebenen Tumorzellen, wodurch ein weiterer therapeutischer Gewinnerzielt wird (GILETTE und GILETTE 1995, GRAY et al. 1953).
Das dritte „R“ steht für die Repopulation. Sowohl Tumorzellen als auch gesunde Zellen durchlaufenwährend einer fraktionierten Bestrahlung den Zellzyklus. Der Untergang von Zellen führt dazu,dass im gesunden Gewebe Stammzellen ihre Proliferationsrate erhöhen und ruhende Zellen wiederin den Zellzyklus eintreten, um tote Zellen zu ersetzen. Dieser Mechanismus führt zur Geweberegeneration.
Leider tritt dies auch bei einigen schnell wachsenden Tumoren vor allem gegen Ende derTherapie
auf, weshalb dann die Dosis entsprechend erhöht werden muss (GILETTE und GILETTE1995, LARUE und
GILETTE 1996).
Das vierte „R“ ist Platzhalter für die Redistribution innerhalb des Zellzyklus. Bei sich raschteilenden Geweben rotieren die Zellen im Zuge der Redistribution zu den radiosensitiven Stadien
Mund G2, wodurch eine Erhöhung der Strahlenempfindlichkeit entsteht.
Wichtig ist es, schon im Vorfeld die Zielsetzung der Strahlentherapie festzulegen, da dies
weitreichende Folgen bezüglich Häufigkeit der Bestrahlung, Gesamtdosis, akzeptierte
Nebenwirkungenund Prognose hat (GILETTE und GILETTE 1995, LARUE und GILETTE 1996). Plant man
eineStrahlentherapie kurativ, so ist es das Ziel, den Tumor langfristig zu kontrollieren oder
gar komplettzu zerstören. Hierbei sind eine höhere Anzahl Fraktionen und somit eine höhere
Gesamtdosisnotwendig, wodurch stärkere Risiken für Nebenwirkungen, mehr Aufwand für Besitzer und
Tierund auch höhere Kosten entstehen.
Kurative Protokolle beim Tier beinhalten 10-20 Fraktionen, die je nach Institution MontagMittwoch-Freitag oder an fünf Folgetagen Montag-Freitag appliziert werden. In der Veterinärmedizin sind Gesamtdosen von 39-63 Gy (Gray, 1 Gy entspricht der absorbierten Energie von1 Joule/kg) üblich. Soll die Behandlung palliativ erfolgen, verfolgt man eine Steigerung derLebensqualität durch Schmerzlinderung und/oder Funktionsverbesserung. Dazu sind wenigerFraktionen (zwei bis fünf) und eine geringere Gesamtdosis (<16-30 Gy) notwendig, wodurch kaumNebenwirkungen zu erwarten sind. Nachteil ist, dass im Gegenzug das Tumorwachstum weniger bisnicht kontrolliert wird (KASER-HOTZ et al. 1994).
2.2.4.4 Nebenwirkungen
Da
Bestrahlung eine lokale Behandlungsform ist, manifestieren sich Nebenwirkungen an Gewebenim
bestrahlten Feld. Am häufigsten sind Haut, Mukosa, andere angrenzende Weichteile und Organewie
auch Knochen betroffen. Werden im Rahmen einer kurativen Bestrahlung die Mukosa vonNase oder
Mund bestrahlt, kommt es hier gegen Ende der Therapie häufig zu einer Rötung undÖdematisierung,
die in der Regel nach zwei bis drei Wochen wieder abklingt (LADUE-MILLER etal.1996, THEON et al.
1997). Bestrahlte Haut kann bis zu zwei Wochen nach Beendigung derTherapie mit schuppiger bis
feuchter Dermatitis reagieren. Des Weiteren wird Haarausfall und einNachwachsen von Haaren
anderer Pigmentierung beobachtet. Auch Haut und Schleimhaut könnenVeränderungen in der
Pigmentierung erfahren. Bei höheren Dosen äußert sich dies meist inPigmentverlust mit
anschließender Hyperpigmentierung. Werden niedrigere Dosen appliziert, führtdies eher direkt zu
Hyperpigmentierung (FRIMBERGER et al. 1997, MCCHESNEY et al. 1989,TURREL et al. 1988).
Am Auge kann es zur Konjunktivitis kommen. In schwereren Fällen entstehen Ulzerationen
derKornea. Bei Verminderung der Tränenproduktion kann eine Keratitis sicca die Folge sein.
Alsmögliche Spätfolge tritt ab etwa sechs Monaten nach Bestrahlung eine Katarakt auf (ADAMS et
al.1998, JAMIESON et al. 1991, ROBERTS et al. 1987). Bei den in der Tiermedizin
gängigenProtokollen sind gravierende Spätschäden wie Knochen-, Haut-, Weichteil- und
Nervennekrosenselten. Dies ist sehr wichtig, da solche Schäden aufgrund fehlender Stammzellen
meist irreversibelsind (LADUE et al. 1999, SCHULTHEISS et al. 1995, TILLER-BORCICH et al.
1987).
2.2.5 TherapieplanungDie Vorarbeit zur Therapieplanung ist abhängig von der Lokalisation des zu bestrahlenden Tumors.Handelt es sich um Tumoren in Bereichen mit kritischen angrenzenden Strukturen (Nasen-,Gehirntumoren, Umfangsvermehrungen über beziehungsweise in den großen Körperhöhlen), ist zurPlanung eine Computertomographie oder Kernspintomographie notwendig. Man bestimmt damitTumorvolumen, Tumorausdehnung und gefährdete Organe. Hat man es mit oberflächlichenTumoren in weniger problematischen Regionen (zum Beispiel den Gliedmaßen) zu tun, ist in denmeisten Fällen die Tumorvermessung und gegebenenfalls ein Röntgenbild zur Planung ausreichend.Neben dem Tumorvolumen umschließt das Zielvolumen auch einen Bereich außerhalb desmakroskopisch nachweisbaren Tumors, bei dem vermutet wird, dass er Tumorzellen enthält. DieHistologie des jeweiligen Tumors bedingt die Größe dieses Sicherheitssaumes. Zudem müssenPositionierungsungenauigkeiten und Atmungsbewegungen einkalkuliert werden. Je nach Komplexität wird zur
Optimierung der Dosisverteilung zum Teil mit multiplen Bestrahlungsfeldern gearbeitet(KASER-HOTZ
2000).
2.2.6 Bestrahlung von Knochentumoren
Da canine
appendikulare Osteosarkome zu den relativ strahlenresistenten Tumoren gehören, ist eineStrahlentherapie makroskopischer Tumoren mit kurativer Intention nach derzeitigem Kenntnisstandnicht indiziert. Demgegenüber lässt sich diese Therapiemodalität als palliative Maßnahme einsetzen.
Hochenergetische Strahlung, wie sie für die Teletherapie von Tumoren eingesetzt wird, führtgemäß
Literatur in 74-92 % der Patienten zu guter Schmerzlinderung bis fast völliger Schmerzausschaltung im bestrahlten Gebiet. Der Erfolg einer palliativen Bestrahlung setzt innerhalb
wenigerTage bis Wochen nach der Strahlentherapie ein (BATEMAN et al. 1994, GREEN et al.
2002,KLEITER et al. 2002, MAYER und GRIER 2006, MCENTEE et al. 1993, MUELLER et al.
2005,RAMIREZ et al. 1999).
Diese Wirkung ist durch verschiedene Mechanismen erklärbar. Die Bestrahlung führt zur
Nekrosevon Tumorzellen und nachfolgendem Ersatz durch fibröses Gewebe. In der Folge kommt es
zurKalzifizierung des Ersatzgewebes und zur Bildung von Faserknochen, der nach und nach
durchlamellären Knochen ersetzt wird. Die sofort auftretende Wirkung wird auf einen
zytotoxischenEffekt gegenüber normalen Knochenzellen, Tumorzellen und Makrophagen zurückgeführt,
diechemische Mediatoren (Prostglandine, vor allem Prostaglandin E2)
freisetzen. Dadurch wird dieAusschüttung von diesen chemischen Mediatoren, die zur
Schmerzwahrnehmung durch Stimulationvon Schmerzrezeptoren im Periost führen, reduziert (MAYER
und GRIER 2006).
Der später einsetzende Effekt (zwei Wochen und darüber hinaus) lässt sich durch die
Rekalzifizierung und Reparatur von osteolytischen Läsionen erklären (MCENTEE et al. 1993). Die einsetzendeSchmerzlinderung dauert median 53-130 Tage mit einer Spanne von 0-580 Tagen. Die Überlebenszeiten dieser
Patienten liegen median bei 122 bis 313 Tagen mit einer Spanne von 7-2035 Tagen(BATEMAN et al.
1994, GREEN et al. 2002, KLEITER et al. 2002, MCENTEE et al. 1993,MUELLER et al. 2005, RAMIREZ
et al. 1999).
Die zur Schmerzausschaltung erforderliche Fraktionszahl und Gesamtdosis liegt signifikant
unterder, die in der Regel für eine kurative Bestrahlungstherapie notwendig wäre. Somit erfüllt
dieBestrahlung zur Schmerzlinderung die klassischen Voraussetzungen für eine palliative
Therapie, dasie durch eine erfolgreiche Schmerzkontrolle zu einer Verbesserung der
Lebensqualität sowieGliedmaßenfunktion führt. Die damit verbundene Verlängerung der
Überlebenszeit betroffenerPatienten ist zwar nicht das Primärziel, wird jedoch häufig beobachtet
(CRONIN et al. 1993,SIEGEL und CRONIN 1997, THRALL und LARUE 1995).
Bestrahlung zur Schmerzlinderung wird in der Humanmedizin vor allem als palliative
Maßnahmebei Knochenmetastasen eingesetzt (HOF und DEBUS 2005, KONSKI et al. 2005, PRICE
etal.1986, RUBIN 1993), wobei man auch hier noch auf der Suche nach dem optimalen
Bestrahlungsprotokoll ist (NEEDHAM et al. 1994, WAI et al. 2004, YOSHIDA und HIRATSUKA 2006).Humanmedizinische radioonkologische Institutionen verwenden verschiedene palliative Behandlungsprotokolle.
Die Gesamtdosen variieren zwischen 4 und 46 Gy (AMICHETTI et al. 2004,HARTSELL et al. 2005, WU
et al. 2004).
Die Anzahl der Fraktionen schwankt zwischen 1 und 23. In der Literatur wird von einer
Ansprechrate auf palliative Bestrahlung zwischen 71-100 % (20-59 % CR) berichtet (HADDAD et al. 2005,POULSEN et al. 1989, ROSZKOWSKI 2005, VAN DER LINDEN et al. 2006). ARCANGELI undMitarbeiter (1998) verglichen drei Gruppen mit unterschiedlichen Fraktionierungsschemata: 20–23x 2 Gy, 10-12 x 3 Gy oder 1-4 x 7-8 Gy. In dieser Studie wurde statistisch nachgewiesen, dasshöhere Gesamtdosen mit einem höheren Prozentsatz an kompletter Schmerzausschaltung undlängerer Wirksamkeit verbunden sind.
PRICE und Mitarbeiter (1986) zeigten, dass eine einzelne Fraktion von acht Gy den
Schmerzebenso effektiv lindert wie zehn tägliche Fraktionen zu drei Gy. Zu ähnlichen Ergebnissen
führtendie Untersuchungen von NIELSON und Mitarbeitern (1998). Hier wurde eine Einzelfraktion
zuacht Gy mit vier Fraktionen zu fünf Gy verglichen. Beide Protokolle führten zu
vergleichbarenErgebnissen bezüglich Grad und Dauer der Schmerzlinderung. JEREMIC und Mitarbeiter
(1998)verglichen Einzelfraktionen zu vier, sechs oder acht Gy. Es bestanden keine Unterschiede
in derDauer des Therapieerfolges, jedoch trat die Schmerzlinderung bei acht Gy schneller ein,
undverglichen mit sechs Gy (73 %) und vier Gy (59 %) erfuhren mehr Patienten eine
kompletteSchmerzausschaltung (78 %).
Liegen multiple Metastasen auf verschiedene Körperareale verteilt vor, muss mit mehreren
Feldernoder gar Halbkörperbestrahlungen gearbeitet werden. Große Bestrahlungsvolumina erfordern
denEinsatz von wenigen und kleinen Fraktionen oder die systemische Anwendung von
Radioisotopen(HOSKIN 1988). JEREMIC und Mitarbeiter (1999) beschäftigten sich mit der
wiederholtenBestrahlung von Knochenmetastasen bei Wiederauftreten von Schmerz. Sie zeigten, dass
eineEinzelfraktion von vier Gy effektiv (74 % Ansprechrate, 31 % CR, 42 % PR) und wenig toxisch
beider Wiederholungsbestrahlung ist.
In der Tiermedizin wird die erfolgreiche Anwendung von Bestrahlung zur Schmerzlinderung
beiappendikularen Knochenläsionen beschrieben, wobei jedoch relativ wenige Publikationen
vorliegen(BATEMAN et al. 1994, GREEN et al. 2002, KLEITER et al. 2002, MAYER und GRIER
2006,MCENTEE et al. 1993, MUELLER et al. 2005, RAMIREZ et al. 1999). BATEMAN und Mitarbeiter
(1994) untersuchten den Erfolg einer palliativen Bestrahlung bei 24 Hunden, wobei nur sechsder
Patienten ein appendikulares Osteosarkom hatten.
Bei der palliativen Bestrahlung caniner Osteosarkome wird von einem Anhalten des Erfolges
über0-580 Tage berichtet. Allerdings bestehen in der zitierten Literatur erhebliche
Unterschiedehinsichtlich des angewendeten Bestrahlungsprotokolls, das heißt der Anzahl der
Fraktionen (2-4),der Fraktionsgröße (6-10 Gy) und der applizierten Gesamtdosis (16-32 Gy)
(BATEMAN et al.1994, GREEN et al. 2002, KLEITER et al. 2002, MAYER und GRIER 2006, MCENTEE et
al.1993, MUELLER et al. 2005, RAMIREZ et al. 1999). Vergleichende Untersuchungen verschiedener
Fraktionierungsschemata hinsichtlich Grad und Dauer der Schmerzausschaltung sowie zu denNebenwirkungen und der Wiederholbarkeit des Verfahrens liegen nur sehr spärlich vor (MUELLER et al. 2005,
RAMIREZ et al. 1999).
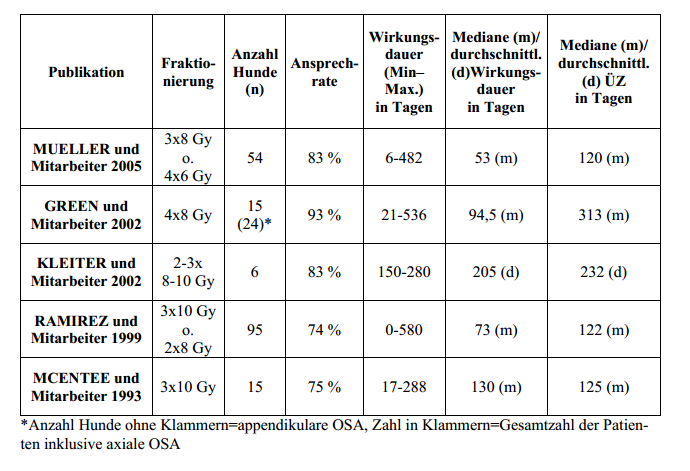
Vergleich der Publikationen zur palliativen Bestrahlung von appendikularen
Osteosarkomen
In einigen Studien wurde bei appendikularen Osteosarkomen die Nutzung von Strahlentherapie
mitkurativer Intention untersucht. THRALL und Mitarbeiter (1990) bestrahlten 21 Hunde mit
appendikularem Osteosarkom präoperativ ohne adjuvante Chemotherapie im Zusammenhang mit gliedma-ßenerhaltenden chirurgischen Maßnahmen. Sie verwendeten eine Dosis von 36 bis 52 Gy in zehnFraktionen. Drei Wochen nach der Bestrahlung erfolgten die chirurgische Tumorexzision und dieImplantation eines Allografts. Die mediane Überlebenszeit aller Patienten betrug vier Monate
(1-18Monate). Bei sieben Patienten musste aufgrund einer schweren lokalen Infektion, Fraktur
desAllografts oder Instabilität der Fixation eine zweite Operation durchgeführt werden. 24 %
derPatienten entwickelten ein Rezidiv und 53 % hatten Probleme mit der Fixation des
Spenderknochens. Aufgrund dieser hohen Komplikationsrate raten die Autoren der Studie von einer neoadjuvanten Radiotherapie in gewählter Dosis und Fraktionierung ab.
WALTER und Mitarbeiter (2005) bestrahlten 14 Hunde mit appendikularem Osteosarkom
mitkurativer Intention. Die mediane Überlebenszeit lag bei 209 Tagen. HEIDNER und
Mitarbeiter(1991) kombinierten die Cobalt60-Bestrahlung mit intraarteriellem Cisplatin in einer Dosis von70 mg/m2
KOF. Das Cisplatin wurde unmittelbar vor der ersten und letzten Bestrahlung
appliziert.Es wurde eine Gesamtdosis von 24-40 Gy in bis zu zehn Fraktionen in einem
M-M-F-Regimeverabreicht. Zum Zeitpunkt der Vorstellung hatten zwei der zwölf Hunde pathologische
Frakturenund zwei Patienten schon sichtbare Fernmetastasen in Lunge oder Haut. Letztere wurden
innerhalbeines Monats nach Therapieende euthanasiert. Man erreichte eine mediane lokale
Kontrolle von 5,9Monaten. Die mediane Überlebenszeit lag insgesamt bei 4,9 Monaten. Für Hunde
ohne feststellbareFernmetastasen zu Therapiebeginn betrug sie 6,7 Monate.
Mehrere humanmedizinische Studien haben ergeben, dass der prozentuale Anteil an
nekrotischemTumorgewebe ein wichtiger Indikator für die Effektivität einer präoperativen
Therapie ist (BACCIet al. 1987, ROSEN et al. 1982, WINKLER et al. 1988). POWERS und Mitarbeiter
(1991) konntenebenfalls nachweisen, dass der prozentuale Anteil nekrotischen Tumorgewebes einen
hohenprädiktiven Wert für die lokale Tumorkontrolle hat. In einer anderen Studie mit 20 Hunden
wurdenverschiedene Behandlungsmethoden vor gliedmaßenerhaltenden Operationen untersucht
(intraarterielle Cisplatingabe mit oder ohne Bestrahlung, intravenöse Cisplatintherapie mit Bestrahlung). Dieeinzelnen Behandlungsgruppen unterschieden sich nicht in der lokalen Tumorkontrolle. Diemediane Überlebenszeit lag bei acht Monaten (1-45 Monate) (LARUE et al. 1989).
WITHROW und Mitarbeiter (1993) applizierten bei 49 Patienten mit appendikularem
OsteosarkomGesamtdosen von 20-40 Gy in zehn gleichen Fraktionen. Cisplatin wurde an Tag 0 und 21
derBestrahlung in einer Dosis von 70 mg/m2 KOF
intraarteriell verabreicht. Betrug die Tumornekroserate weniger als 75 %, so erlitten 65 % der Patienten nach einem Jahr ein lokales Rezidiv. Lag dieNekroserate bei über 75 %, so erfuhren nur 15 % ein lokales Rezidiv. Die Tumornekroserate wardamit der wichtigste prädiktive Faktor im Hinblick auf ein lokales Rezidiv. Eine Gesamtdosis von32 Gy in Verbindung mit zwei intraarteriellen Cisplatingaben reichte aus, um diese hohe Nekroserate zu
bewirken. Größere Bestrahlungsdosen (36-40 Gy) waren mit einer hohen Inzidenz für dasVersagen
der Spenderknochen verantwortlich. Die mediane Überlebenszeit lag bei 9,3 Monaten(1,5-38
Monate), das mediane krankheitsfreie Intervall bei 7,2 Monaten (3-13 Monate).
Verschiedene Forschungsgruppen untersuchten den Einsatz von 153Samarium für die Behandlungvon appendikularen und axialen Knochentumoren (BARNARD et al. 2007, LATTIMER et al. 1990,MILNER et al. 1998, MOE et al. 1996). 153Samarium ist ein Radioisotop, das sowohl ß-Partikel alsauch Gammastrahlen emittiert. Es verteilt sich im Skelett entsprechend 99Technetium, so dass manper Knochenszintigraphie die Selektivität und Effektivität von 153Samarium in einer vorhandenenLäsion vorhersagen kann (LATTIMER et al. 1990). LATTIMER und Mitarbeiter (1990) therapierten 40 Hunde mit
verschiedenen primären Sarkomen des Knochens in appendikularer und axialerLokalisation mit ein
oder zwei i.v.-Dosen von 37 MBq (=1 mCi)/kg. Die beste Wirkung konnteman bei kleinen Läsionen
mit wenig Lyse, bei nicht das Periost durchbrechenden Veränderungen,bei metastatischen
Knochenveränderungen und Neoplasien im axialen Skelett beobachten.
MILNER und Mitarbeiter (1998) stellten fest, dass Strahlentherapie mit 153Samarium in sieben vonacht behandelten Hunden mit Osteosarkomen des Gliedmaßenskeletts weder Schmerzkontrollenoch Antitumoreffekt erreichte. Sieben Tumoren wuchsen progressiv. Nur ein Tumor, lokalisiert inder Skapula, ging in komplette Remission und wurde über 20 Monate als rezidivfrei eingestuft. Ineiner anderen Studie wurde ein rezidiviertes maxillares Osteosarkom nach marginaler Resektion
mitzwei Injektionen von 153Samarium (43 und 45 MBq/kg) im Abstand von 15 Wochen behandelt. DerPatient überlebte länger als 21 Monate. Es waren weder ein lokales Rezidiv noch Fernmetastasenfestzustellen (MOE et al. 1996).
Es gibt wenige Berichte und Erfahrungen über Teletherapie bei Osteosarkomen der
Kieferknochen(DICKERSON et al. 2001, HEYMAN et al. 1992, STRAW et al. 1996). STRAW und
Mitarbeiter(1996) verglichen verschiedene Therapiemodalitäten (partielle Mandibulektomie alleine
oder inKombination mit Chemotherapie und/oder Radiotherapie) bei 51 Hunden mit
mandibuläremOsteosarkom. Sie konnten keine Unterschiede im Behandlungserfolg feststellen. Im
Rahmen einerretrospektiven Analyse von 22 Hunden mit axialem Osteosarkom wiesen DICKERSON
undMitarbeiter (2001) nach, dass Radiotherapie mit kurativer Intention die Überlebenszeiten
derPatienten im Vergleich zu palliativ bestrahlten signifikant verlängerte. Hunde, die palliativ
mit zweibis drei wöchentlichen Fraktionen zu je 10 Gy therapiert wurden, hatten eine mediane
Überlebenszeit von 79 Tagen. Patienten, die eine intensive Radiotherapie in Form von 15-19 Fraktionen zu je3 Gy drei- bis fünfmal wöchentlich erhielten, erreichten eine mediane Überlebenszeit von 265Tagen.
3 Tiere, Material und Methoden
3.1 Einschlusskriterien
In die
Studie integriert wurden 30 Hunde mit einem Osteosarkom der langen Röhrenknochen (alleLokalisationen), das mit einer sichtbaren Lahmheit (siehe Kapitel 4.2) und typischen röntgenologischen
Knochenveränderungen (siehe Kapitel 4.5) einherging. Hunde mit einer röntgenologisch odercomputertomographisch darstellbaren pathologischen Fraktur des tumorös betroffenen Knochenswurden ausgeschlossen. Patienten, die bereits zuvor eine Strahlentherapie des betroffenen Knochensegments
erhalten hatten, wurden ausgeschlossen. Ebenso nicht zugelassen wurden Patienten mitschwerwiegenden systemischen Erkrankungen, die nach ärztlichem Ermessen mit einer nur kurzenLebenserwartung einhergehen oder bei denen aus diesem Grunde mit Problemen hinsichtlich dernotwendigen Anästhesie zu rechnen gewesen wäre. Kein Ausschlusskriterium waren Vorbehandlungen mit
unterschiedlichen Schmerzmitteln, auch Kortikosteroiden, oder nodulären Lungenverschattungen.
3.2 Diagnose und klinische Stadieneinteilung
a) Klinische Allgemeinuntersuchung. Bei allen Hunden erfolgte eine Blutuntersuchung. Es wurdeein komplettes Blutbild mit Leukozyten-, Erythrozyten- und Thrombozytenzählung, sowie Differentialblutbild per Vet ABC® (animal blood counter von scil animal care, Viernheim,Deutschland) in der Tierklinik Hofheim angefertigt. Das Blutserum wurde zur Überprüfung derNierenfunktion (Harnstoff-N, Kreatinin, Gesamteiweiß, Natrium, Chlorid, Kalium, anorganisches Phosphat), Leber- (Gesamt-Bilirubin, ALT, ALKP, γ-GT, AST, GLDH, Serumalbumin),Pankreas- (Glucose, α-Amylase, Lipase, Cholesterin, Fruktosamin) und Muskelparameter (CK,LDH, Calcium, korrigiertes Calcium, Magnesium, Triglyceride gesamt) in ein tiermedizinischesLabor (Vet-Med-Labor, Ludwigsburg, Deutschland) eingeschickt.
b) Feststellung des Grades der Schmerzhaftigkeit anhand der Funktionseinschränkung derGliedmaße, des Appetits und der Aktivität (Gradeinteilung gemäß Anhang 2)
c) Beurteilung des Grades der Muskelatrophie der betroffenen Gliedmaße (Umfang des Oberschenkels beziehungsweise Oberarmes im Vergleich zur kontralateralen Seite)
d) Röntgenuntersuchung der betroffenen Gliedmaße in zwei Ebenen
e)
Computertomographische Untersuchung des Tumors
f) Röntgenuntersuchung des Thorax in drei Ebenen (ventrodorsaler sowie rechts- und linksanliegender laterolateraler Strahlengang)
g) Computertomographische Untersuchung des Thorax
h)
Histologische Untersuchung des Tumors post mortem (sofern möglich). Auf eine histologischeUntersuchung vor Beginn der Therapie wurde bewusst verzichtet, da eine Biopsienahme zurstatischen Schwächung des Knochens und dadurch zur Förderung pathologischer Frakturenbeitragen kann. Des Weiteren kann es zur Tumorausbreitung entlang des Stichkanals kommen(DERNELL et al. 2001, LIPTAK et al. 2004, WYKES et al. 1985). Stattdessen wurde die Diagnose "Osteosarkom"
per Feinnadelaspiration (BRITT et al. 2007, SAMII et al. 1999, STOCKHAUS et al. 2003) zum Zeitpunkt der ersten Bestrahlung gestellt oder anhand postmortal gewonnener histologischer Gewebeproben
etabliert. Die Feinnadelaspiration erfolgte mit einer 10-ml-Spritze, einer Kanüle der Stärke 20
G und einer Aspirationspistole. Es wurde eine LT-SYS®Haema-Schnellfärbung (Labor+Technik, Berlin, Deutschland) durchgeführt. Die zytologischeAuswertung wurde in der Tierklinik Hofheim vorgenommen. Die Probenentnahme zur histologischen Untersuchung
post mortem erfolgte mit einem Knochentrepan mit 5 mm Durchmesser.Die Proben wurden in eine 4
%ige Formalinlösung eingebettet und in der Praxis für Tierpathologie Dr. med. vet. Dietrich v. Bomhard in München untersucht.
3.3 Röntgenuntersuchung, Computertomographie und Bestrahlung
Die Röntgenuntersuchungen wurden analog mit einer Röntgenanlage von Siemens (Tridoros 512,Siemens Medical, München, Deutschland) in der Tierklinik Hofheim angefertigt. Es kamen AGFARöntgenkassetten (AGFA CURIX fine 100, AGFA, Köln, Deutschland) und Typon Röntgenfilme(Typon Contatyp CX-6R, Typon Medical Systems AG, Burgdorf, Schweiz) zum Einsatz. DieRöntgenuntersuchung des Thorax erfolgte mit einer Belichtung von 73 kV und fünf mAs und dieder Gliedmaße je nach Objektdicke mit 57 bis 60 KV und fünf bis 6,3 mAs.
Zur Computertomographie und Bestrahlung wurden die Hunde anästhesiert (siehe Kapitel 3.6). Diecomputertomographische Untersuchung des Knochentumors und des Thorax erfolgte in derTierklinik Hofheim zum Zeitpunkt der ersten Bestrahlungsbehandlung mit einem Toshiba Computertomographen
(Asteion Model TSX-021B, Toshiba Medical Systems, Neuss, Deutschland). Fürden Knochentumor
wurden abhängig von Lokalisation und Längenausdehnung Schichtdickenzwischen ein und fünf mm,
Faltungkern 30 oder 81, eine Spannung von 120-135 kV und eineStromstärke zwischen 50 und 150 mA
gewählt. Im Regelfall kam eine Schichtdicke von zwei bisdrei mm zum Einsatz. Für sehr kurze
Tumoren wurde eine Schichtdicke von einem mm und für sehrlange Tumoren von fünf mm
benutzt.
Die Thoraxuntersuchung erfolgte immer in Form von Spiralaufnahmen mit fünf mm
Schichtdicke,einem Pitch von 1,5, Faltungskern 51, 120 kV Spannung und 100 mA Stromstärke. Die
Auswertungder Röntgenbilder und der computertomographischen Untersuchungen nahm der Fachtierarzt
fürRadiologie Dr. Markus Tassani-Prell der Tierklinik Hofheim vor.
Die Bestrahlung erfolgte ebenfalls in der Tierklinik Hofheim mit einer Philips 60Cobalt-TeletherapieAnlage (Philips Medizin Systeme, Hamburg, Deutschland). Die zu wählende Feldgröße wurdeanhand mediolateraler Röntgenbilder ermittelt. Zu den röntgenologisch sichtbaren Tumorgrenzenwurde wegen des invasiven Wachstums von Osteosarkomen ein Sicherheitsrand von drei cm inproximaler und distaler Richtung addiert. Es wurden parallel opponierende Bestrahlungsfelder mitgleicher Gewichtung der Dosis gewählt. Angaben zur Anzahl der Bestrahlungsfraktionen und derFraktionsgröße sind in Kapitel 3.4 zu finden. Sofern das Tumorwachstum es zuließ, wurde einlongitudinaler Hautstreifen aus dem Bestrahlungsfeld exkludiert, um das Risiko einer Obstruktionder Lymphgefäße zu minimieren.
3.4 Versuchsgruppen und Behandlungsprotokolle
30 Hunde mit appendikularen Knochentumoren wurden in zwei Gruppen zu je 15 aufgeteilt. DiePatienten wurden randomisierend immer abwechselnd nach dem Datum der Diagnosstellung denzwei Gruppen zugeteilt. Abweichungen von dieser abwechselnden Einteilung in Gruppe 1 und 2wurden nur vereinzelt toleriert, wenn die Behandlung sonst für die Besitzer aus logistischenGründen nicht durchführbar war. Gruppe 1 wurde mit 3x9 Gy an den Tagen 0-7-21 bestrahlt. InGruppe 2 wurden 5x4 Gy möglichst an Folgetagen appliziert. Das Fraktionierungsschema derGruppe 1 mit drei Fraktionen an Tag 0-7-21 ist ein in der Tiermedizin häufig verwendetes Protokoll. Die
üblichen Fraktionsgrößen variieren von 8 bis 10 Gy, so dass die gewählten 9 Gy genau indiesem
Rahmen liegen (KLEITER et al. 2002, MCENTEE et al. 1993, RAMIREZ et al. 1999). Zieldes
Protokolls der Gruppe 2 war, die geplante Gesamtdosis möglichst in einem kurzen Zeitraum zuapplizieren, um zu sehen, ob dies Einfluss auf den Zeitraum bis zum Wirkungseintritt, den Grad
derWirkung und die Wirkungsdauer hat. Das Auftreten von akuten Nebenwirkungen, wie
einerstrahleninduzierten Dermatitis, sollte möglichst vermieden werden. Die Verwendung von
niedrigerdosierten Einzelfraktionen senkt das Risiko für spät auftretende Gewebeschäden wie
Knochen- undHautnekrosen oder Muskelfibrosen (LADUE et al. 1999, SCHULTHEISS et al. 1995,
TILLERBORCICH et al. 1987).
3.5 Medikamentöse begleitende Therapie
Die Vorbehandlung mit Medikamenten zur Schmerzlinderung hatte keinen Einfluß auf die Versuchsgruppenbildung. Die Hunde erhielten die zu Bestrahlungsbeginn verabreichten Analgetikaund/oder Kortikosteroide in unveränderter Weise weiter, da ein Absetzten der Medikamente zurVerschlechterung der Lahmheit oder eine Umstellung zur bestrahlungsunabhängigen Veränderungder Lahmheit hätte führen können.
3.6 Anästhesie
Für die computertomographische Untersuchung und die Bestrahlung war es notwendig, die Hundezu anästhetisieren, damit eine exakte Lagerung gewährleistet werden konnte. Das Narkoseprotokollsollte auch für ältere Patienten gut verträglich und kurz wirksam sein. Allen Patienten wurde einvenöser Zugang gelegt.Die Narkoseinduktion erfolgte mit einem intravenösen Bolus Diazepam (diazep-ct® 10 mg/2 ml, ctArzneimittel GmbH, Berlin, Deutschland; 0,5-1 mg/kg KM) und Propofol (Narcofol®, CP-Pharma,Burgdorf, Deutschland; 2-4 mg/kg KM). Danach wurden die Patienten orotracheal intubiert. DieInhalationsanästhesie erfolgte mit einem Gemisch aus Sevofluran (Sevorane®, Abbott GmbH & Co.KG, Wiesbaden, Deutschland; Einleitung 6-8 Vol.-%, Erhaltung 3-4 Vol.-%) oder Isofluran(Isoba®, Essex Tierarznei, München, Deutschland; Einleitung 3-4 Vol.-%, Erhaltung 0,6-1,5 Vol.-%) und Sauerstoff (0,4-0,8 L/min).
3.7
Verlaufskontrolle
Ein
Ansprechen auf die Therapie wurde danach beurteilt, ob eine Schmerzlinderung mit verminderter Lahmheit der betroffenen Extremität und Verbesserung der Lebensqualität zu beobachten
war.Als Wirkungsdauer wurde der Zeitraum zwischen klinischer Verbesserung und erneuter
deutlicherLahmheitsverschlechterung definiert. Zu Beginn der Therapie erhielten die Besitzer
einen wöchentlich zu ergänzenden Fragebogen, auf dem Angaben zu Lokalreaktionen und Lebensqualität zudokumentieren waren (Anhang 3). Die Verlaufskontrollen in der Tierklinik Hofheim wurden gemäßfolgendem Zeitplan vorgenommen:
1) erste Nachkontrolle sechs Wochen nach Therapiebeginn- Beurteilung des Therapieerfolges (Lahmheitsgrad) durch den Tierarzt.
2) zweite Nachkontrolle 12 Wochen nach Therapiebeginn- Beurteilung des Therapieerfolges (Lahmheitsgrad) durch den Tierarzt- Röntgenbilder des Thorax und der Gliedmaße (sofern möglich in zwei Ebenen)
3) danach klinische Untersuchung mit Röntgenuntersuchung alle acht Wochen bis zum Lebensende des PatientenEs wurde angestrebt, die Euthanasie in der Tierklinik Hofheim durchzuführen, um post mortaleRöntgenaufnahmen anzufertigen und eine Biopsie des Knochens zu entnehmen.
3.8
Wiederholungsbehandlung
Bei Wiederauftreten von Schmerzen wurden, wenn es aufgrund eines zufrieden stellenden Ansprechens bei der ersten Bestrahlung und eines ausreichend guten Zustandes von Patient und Knochensinnvoll erschien, Patienten der Gruppe 1 (3x9 Gy) erneut mit einmal neun Gy und die der Gruppe 2(5x4 Gy) erneut mit fünfmal vier Gy bestrahlt.
3.9
Patientendaten
Die
Bestrahlungen fanden in einem Zeitraum von 14 Monaten (09.01.2003 bis zum 01.03.2004) inder
Tierklinik Hofheim statt. Insgesamt wurden 30 sowohl reinrassige Hunde als auch Mischlingshunde behandelt
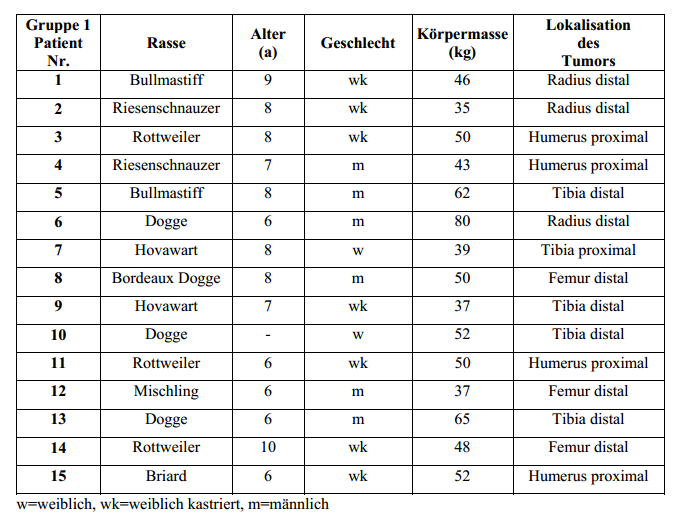
Patientendaten der Hunde aus Gruppe 1 (Rasse, Alter, Geschlecht, Körpermasse
und Tumorlokalisation)
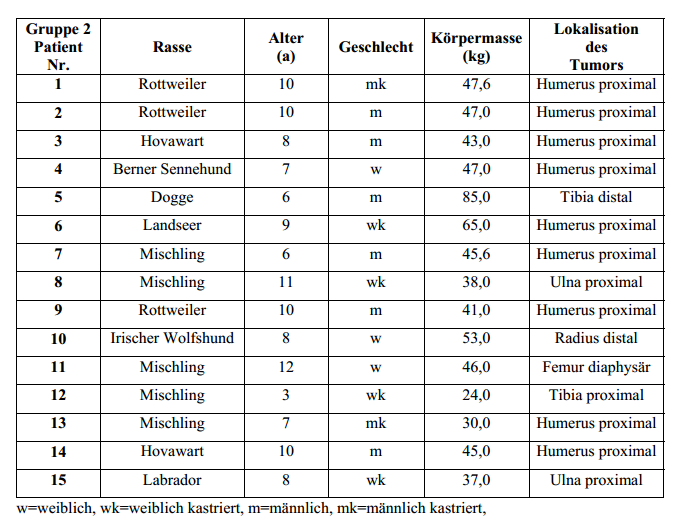
Patientendaten der Hunde aus Gruppe 2 (Rasse, Alter, Geschlecht, Körpermasse
und Tumorlokalisation)
3.10 Statistische Methoden
Die statistische Auswertung der Daten wurde in der Tierärztlichen Hochschule in Hannovervorgenommen. Die Auswertung erfolgte mit dem Statistikprogramm SPSS® (SPSS
Inc Headquaters, Chicago, Illinois, USA). Es wurden für die einzelnen Parameter arithmetischer Mittelwert,Median und Standardabweichung ermittelt. Per Korrelationskoeffizienten wurde der Grad desZusammenhangs zwischen den einzelnen Variablen (Tumorlokalisation, Geschlecht, Lahmheitsgradvor der Bestrahlung, prozentuale Knochenbeteiligung, Lyseindex, Erhöhung der ALKP, Erniedrigung der RBC,
Muskelatrophie der betroffenen Gliedmaße, Körpermasse, Alter, Vorbehandlungmit Schmerzmittel,
Verwendung von Protokoll 1 oder 2) und dem Ergebnis (Dauer der Schmerzlinderung, Verbesserung des Lahmheitsgrades, Beginn der Schmerzlinderung, Dauer der Überlebenszeit) ermittelt. Es wurden
Korrelationskoeffizienten nach Spearman und Pearson errechnet. Beieiner
Irrtumswahrscheinlichkeit von p<0,05 wurden Differenzen als signifikant bewertet.
4 Ergebnisse
Die Darstellung der Ergebnisse erfolgt in Form des Gesamtresultates für alle 30
Studienteilnehmer.Hinter dem Gesamtergebnis sind die Resultate für die einzelnen Gruppen
(Gruppe1/Gruppe2)aufgeführt. Ermittelte Parameter werden als Minimal-Maximal-Spanne dargestellt,
gefolgt vonDurchschnitts- und Medianwert sowie Standardabweichung in eckigen Klammern
[Durchschnittswert(Gruppe1/Gruppe2)/Median(Gruppe1/Gruppe2)/Standardabweichung]. Bei manchen Parametern wird auf die Angabe der Standardabweichung verzichtet und nur Durchschnittswert
undMedianwert angegeben [Durchschnittswert(Gruppe1/Gruppe2)/Median(Gruppe1/Gruppe2)].
4.1 Klinische Allgemeinuntersuchung, Blutuntersuchungen
Bei keinem der Patienten wurde bei der klinischen Untersuchung eine Störung des Allgemeinbefindens
diagnostiziert, die zum Ausschluss aus der Studie geführt hätte. Die Tumorlokalisation war beieinem Teil der Patienten schon innerhalb der klinischen Untersuchung durch Adspektion undPalpation einer Schwellung des Weichteilgewebes und Knochenverdickung festzustellen. Bei denanderen Hunden war die Lokalisierung des Tumors erst röntgenologisch möglich. Die häufigstenVeränderungen der Laborwerte waren eine Erniedrigung der RBC bei 11 Patienten (7/4) und eineErhöhung der ALKP Serum bei 18 Hunden (9/9). Die erhöhten Werte für die ALKP lagen zwischen117 und 969 U/L. Das Labor arbeitete mit einer Obergrenze von 108 U/l. Die erniedrigten Werte
fürdie RBC befanden sich im Bereich von 5,04 bis 5,9 T/l. Die untere Grenze für die
Erythrozytenzahlen wurde vom Labor bei 6,0 T/l festgelegt.

Verteilung der häufigsten Blutwertveränderungen der Patienten insgesamt und
aufgeteilt nach Gruppen 1 und 2 am ersten Behandlungstag (ALKP im Referenzbereich (Rb),
Erhöhung der ALKP über 108 U/l, RBC im Referenzbereich, Erniedrigung der RBC unter 6 T/l)
4.2 Grad der Schmerzhaftigkeit und Funktionseinschränkung der Gliedmaße
Die Lahmheit am ersten Bestrahlungstag wurde gemäß Anhang 2 in die Grade 0-4 eingeteilt. Dabeiwaren alle Lahmheitsgrade von 1-4 vorhanden [2,6(2,5/2,7)/2,75(2,5/3)/0,6865]. Zwei Patientenwaren kurzfristig unter Gabe von Schmerzmittel lahmheitsfrei oder zeigten nur an manchen Tageneine deutliche Lahmheit. Bei Lahmheitsangaben zwischen verschiedenen Graden wurde arithmetisch gemittelt und
gerundet. Die Lahmheit der betroffenen Gliedmaße bestand seit zwei bis 54Wochen
[13(11,2/14,9)/7(6/9)/13,9517]. 17 Patienten (7/10) waren mit NSAIDs vorbehandelt, fünfHunde
(2/3) mit einer Kombination aus NSAID und Kortikosteroid, acht Patienten (6/2) hattenzuvor kein
Schmerzmittel erhalten.

Verteilung der Lahmheitsgrade am ersten Behandlungstag (Grad 0=keine
Lahmheit, Grad 1=geringgradig, Grad 2=stetig belastet, deutlich geringgradig,
Grad 3=nicht stetig belastet, mittelgradig, Grad 4=keine Belastung,
hochgradig)
4.3 Appetit und Aktivität zur Objektivierung der Einschätzung der Lebensqualität
Zur Beurteilung der Lebensqualität vor der Bestrahlungstherapie und an den Kontrollterminen nachder Radiotherapie wurden die Besitzer neben dem Lahmheitsgrad auch zu Appetit und Aktivitätbefragt. Beides wurde ebenfalls gemäß Anhang 2 in Grade zwischen 0 und 3 eingestuft. Vor derBestrahlungstherapie lag der Appetit bei allen 30 Patienten zwischen Grad 0 und 1[0,13(0,07/0,2)/0(0/0)], die Aktivität zwischen Grad 0 und 3 [1(1/1)/1(1/1)].

Verteilung der Grade an Appetit und Aktivität am ersten Behandlungstag (Grad
0=Appetit und Aktivität normal, Grad 1=Appetit und Aktiviät etwas vermindert,
Grad 2=Appetit schlecht beziehungsweise wenig unnötige Aktivität, Grad
3=inappetent beziehungsweise nur noch für Kot- und Urinabsatz
aktiv)
4.4 Grad der Muskelatrophie der betroffenen Gliedmaße
Zur Ermittlung der Muskelatrophie wurde der Umfang des betroffenen und des gesunden Beines beiTumoren der Vordergliedmaße knapp über dem Ellbogen beziehungsweise bei Tumoren derHintergliedmaße knapp über dem Knie ermittelt. Lag der Tumor im Messbereich, konnte es durchSchwellung zu einer Verfälschung des Messergebnisses kommen. Deshalb wurden diese Patientenbei Beurteilung der Muskelatrophie nicht berücksichtigt. Bei 19 Patienten (9/10) war eine Muskelatrophie zu messen. Bei drei Hunden (1/2) hatten beide Gliedmaßen den gleichen Umfang. AchtHunde (5/3) wurden bezüglich dieses Parameters nicht ausgewertet. Die Muskelatropie reichte von-2 cm bis -0,4 cm [-1,05(-0,9/-1,2)/-0,5(-0,5/-0,6)/0,7856].
4.5 Röntgenuntersuchung und computertomographische Untersuchung des Tumors
Auf den Röntgenbildern konnten die typischen Röntgenbefunde eines Osteosarkoms (gemischtosteolytisch-osteoproliferatives Erscheinungsbild mit periostalen Knochenspikulationen) inunterschiedlichem Ausmaß nachgewiesen werden. Wie auch schon in der Literatur beschrieben,waren beide Komponenten sehr unterschiedlich vertreten. Die Anhebung des Periosts durch neugebildeten Knochen im Bereich der Läsion führte bei einem Teil der Patienten zur Ausbildung descharakteristischen "Codman'schen Dreiecks".
Zudem bestand bei vielen Hunden eine lokale Weichteilschwellung, in der zum Teil mineralisierteHerde zu finden waren. Auch bei den Patienten der vorliegenden Studie war die Grenze zwischengesundem und tumorösem Gewebe häufig unscharf. Der prozentual vom Tumor betroffene Anteilder Knochenlänge wurde anhand eines mediolateralen Röntgenbildes ermittelt. Die geringsteAusdehnung betrug 16,3 %, die größte 83,3 % [39,1(36,0/42,2)/41(41,2/34,6)/15,0286]. Der Typder Knochenveränderung hinsichtlich des Anteils von Lyse und Proliferation wurde gemäß Tabelle13 in Anlehnung an ein von RAMIREZ und Mitarbeitern (1999) benutztes Einteilungsschema denIndices zugeordnet. Drei Patienten (2/1) bekamen Index I, sechs Patienten (3/3) Index II, achtPatienten (4/4) Index III, zehn Patienten (6/4) Index IV und drei Patienten (-/3) Index
V.

Einteilung der Knochentumoren in verschiedene Lysegrade:
Index I: fast ausschließlich Lyse, Index II: Lyse>Proliferation,
Index III: Lyse=Proliferation, Index IV: Proliferation>Lyse,
Index V: fast ausschließlich Proliferation
Die Tumorlänge wurde separat per Röntgenaufnahme und per Computertomographie ermittelt
undverglichen. Eine Korrektur für den Vergrößerungseffekt eines Röntgenbildes wurde nicht
durchgeführt. Bei den computertomographischen Darstellungen der Tumoren wurde die Anzahl an Schichten ermittelt, auf denen Hinweise auf Tumorinfiltration bestanden. Zur Erfassung der Länge
wurdedie Anzahl an Schichten mit der Schichtdicke multipliziert. Die so errechneten Ergebnisse
wurdenanhand der rekonstruierten Sagittalschnitte kontrolliert. Acht Tumoren (4/4) wurden
bezüglich derLängenausdehnung in der CT und im Röntgenbild gleich eingeschätzt. Ein Tumor (1/-)
wurde inder CT 0,1 cm kürzer als im Röntgenbild und 21 Neoplasien (10/11) in der CT um 0,2 bis
6,8 cm,durchschnittlich 2,37 cm (2,02/2,68), länger beurteilt. Im Folgenden sind CT-Bilder und
Röntgenbilder zur Demonstration der verschiedenen Lysegrade von appendikularen Knochentumorendargestellt.

CT-Bilder und Röntgenbilder zur Demonstration der verschiedenen Lysegrade
appendikularer Knochentumoren: Lysegrad I
Patient 8 Gruppe 1, lytische Läsion distal im Femur
Länge Tumor im Röntgenbild: 5,5 cm, Länge Tumor in der CT: 5,5
cm

CT-Bilder und Röntgenbilder zur Demonstration der verschiedenen Lysegrade
appendikularer Knochentumoren: Lysegrad I
Patient 2 Gruppe 2, lytische Läsion proximal im Humerus,
Länge Tumor im Röntgenbild: 6,5 cm, Länge Tumor in der CT: 6,6
cm

CT-Bilder und Röntgenbilder zur Demonstration der verschiedenen Lysegrade
appendikularer Knochentumoren: Lysegrad II
Patient 14 Gruppe 2, mehr lytische als proliferative Läsion proximal im Humers
Länge Tumor im Röntgenbild: 10,0 cm, Länge Tumor in der CT: 11,4
cm
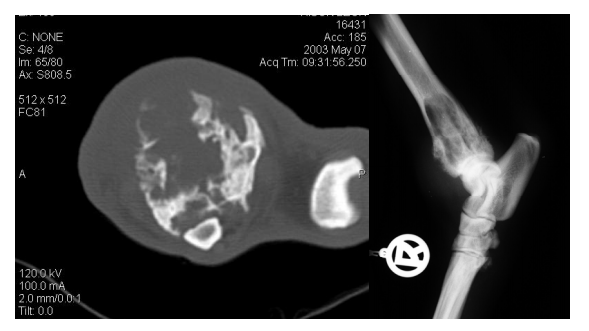
CT-Bilder und Röntgenbilder zur Demonstration der verschiedenen Lysegrade
appendikularer Knochentumoren: Lysegrad II
Patient 13 Gruppe 1, mehr lytische als proliferative Läsion distal in der Tibia
Länge Tumor im Röntgenbild: 9,0 cm, Länge Tumor in der CT: 9,2
cm

CT-Bilder und Röntgenbilder zur Demonstration der verschiedenen Lysegrade
appendikularer Knochentumoren: Lysegrad III
Patient 12 Gruppe 1, lytische=proliferative Läsion distal im Femur
Länge Tumor im Röntgenbild: 11,5 cm, Länge Tumor in der CT: 11,5
cm

CT-Bilder und Röntgenbilder zur Demonstration der verschiedenen Lysegrade
appendikularer Knochentumoren: Lysegrad III
Patient 8 Gruppe 2, lytische=proliferative Läsion proximal in der Ulna
Länge Tumor im Röntgenbild: 12,0 cm, Länge Tumor in der CT: 12,9
cm

CT-Bilder und Röntgenbilder zur Demonstration der verschiedenen Lysegrade
appendikularer Knochentumoren: Lysegrad IV
Patient 10 Gruppe 2, mehr proliferative als lytische Läsion distal im Radius
Länge Tumor im Röntgenbild: 6,0 cm, Länge Tumor in der CT: 8,0
cm

CT-Bilder und Röntgenbilder zur Demonstration der verschiedenen Lysegrade
appendikularer Knochentumoren: Lysegrad IV
Patient 7 Gruppe 2, mehr proliferative als lytische Läsion proximal im Humerus
Länge Tumor im Röntgenbild: 16,0 cm, Länge Tumor in der CT: 16,0
cm

CT-Bilder und Röntgenbilder zur Demonstration der verschiedenen Lysegrade
appendikularer Knochentumoren: Lysegrad V
Patient 11 Gruppe 2, proliferative Läsion in der Femurdiaphyse
Länge Tumor im Röntgenbild: 20,0 cm, Länge Tumor in der CT: 22,0
cm

CT-Bilder und Röntgenbilder zur Demonstration der verschiedenen Lysegrade
appendikularer Knochentumoren: Lysegrad V
Patient 15 Gruppe 2, proliferative Läsion proximal in der Ulna
Länge Tumor im Röntgenbild: 3,5 cm, Länge Tumor in der CT: 3,8
cm
4.6 Röntgenuntersuchung und computertomographische Untersuchung des Thorax
Bei
Behandlungsbeginn konnten bei sechs Patienten (2/4) sowohl röntgenologisch als auch perComputertomographie zwei oder mehrere (bis multiple) noduläre Lungenverschattungen nachgewiesen werden.
Hinweise für eine Vergrößerung von intrathorakalen Lymphknoten gab es wederröntgenologisch noch
per Computertomographie. Bei drei Patienten wurden in der CT zwei bis dreiRundherde der Lunge
mehr nachgewiesen, als anhand der Röntgenbilder zu vermuten gewesenwäre.

Darstellung der Thorax-Röntgenuntersuchung und –CT von drei der sechs
Patienten mit nodulären Lungenverschattungen zu Behandlungsbeginn (gestrichelte Linie im
Röntgenbild demonstriert die Schnittebene des CT-Bildes)
Patient 14 Gruppe 1
CT: 3 noduläre Lungenverschattungen, Röntgenuntersuchung: 2-3 noduläre
Lungenverschattungen

Darstellung der Thorax-Röntgenuntersuchung und –CT von drei der sechs
Patienten mit nodulären Lungenverschattungen zu Behandlungsbeginn (gestrichelte Linie im
Röntgenbild demonstriert die Schnittebene des CT-Bildes)
Patient 13 Gruppe 2
CT: multiple noduläre Lungenverschattungen, Röntgenuntersuchung: multiple
noduläre Lungenverschattungen

Darstellung der Thorax-Röntgenuntersuchung und –CT von drei der sechs
Patienten mit nodulären Lungenverschattungen zu Behandlungsbeginn (gestrichelte Linie im
Röntgenbild demonstriert die Schnittebene des CT-Bildes)
Patient 4 Gruppe 2
CT: 3 noduläre Lungenverschattungen, Röntgenuntersuchung: 3 noduläre
Lungenverschattungen
4.7 Histologische Untersuchung des Tumors
Zum Zeitpunkt der Erstvorstellung der Patienten lag in sieben Fällen der histologisch
abgesicherteBefund eines Osteosarkoms (Gruppe 1: Patienten 1, 10 und 14; Gruppe 2: Patienten 12
und 15),Osteochondrosarkoms (Gruppe 2: Patient 13) oder Sarkoms (Gruppe 2: Patient 3) vor. Bei
weiterensieben Patienten konnte post mortem oder nach Amputation eine Biopsie per
Knochentrepanentnommen werden. Bei fünf von diesen sieben Patienten konnte ein Osteosarkom
(Gruppe 1:Patienten 5, 8 und 11; Gruppe 2: Patienten 1 und 2) nachgewiesen werden. Bei einem
Patienten(Gruppe 1: Patient 2) war die Probe hinsichtlich Malignität positiv, eine genauere
Spezifierung warjedoch nicht möglich. Eine Biopsie (Gruppe 2: Patient 6) kam mit unklarem
Ergebnis zurück, da inder Probe unregelmäßig gebildeter neuer Knochen auffindbar war, aber keine
Zellen, die sicher fürein Osteosarkom gesprochen hätten.
Auf Besitzerwunsch konnte bei neun euthanasierten Patienten keine histologische Bestätigung
mehrstattfinden (Gruppe 1: Patienten 3, 4, 6 und 9; Gruppe 2: Patienten 4, 5, 7, 8 und 11). Bei
siebenPatienten konnte per Feinnadelaspiration der röntgenologische Verdacht eines
Osteosarkomsbestätigt werden (Gruppe 1: Patienten 7, 12, 13 und 15; Gruppe 2: Patienten 9, 10
und 14). Da essich im Verlaufe der Studie herausstellte, dass viele Besitzer eine
Biopsieentnahme nach dem Todeihres Tieres ablehnten, wurde in einer späteren Studienphase zu
einer zytologischen Absicherungdurch Feinnadelaspiration übergegangen.
4.8 Zeitraum ab Beginn der Bestrahlung bis zum Wirkungseintritt der Schmerzlinderung
Die Dauer ab dem Tag der ersten Bestrahlung bis zum Wirkungseintritt war in beiden Gruppenvariabel. Insgesamt reichte das Spektrum von 1-25 Tagen (1-20/2-25) [7(9/6)/6(8/5)/5,8737].
4.9 Wirkung und deren maximales Ausmaß
Die
Wirkung der Bestrahlung wurde durch eine Verbesserung des initial festgestellten Lahmheitsgrades oder einer verbesserten Lebensqualität durch Schmerzreduktion definiert. Letzterewurde durch eine Verbesserung von Appetit und Aktivität und/oder eine Reduktion bis Unterlassung der
Schmerzäußerungen, wie zum Beispiel Jaulen und Winseln, definiert. Es kam unabhängigvom
Zeitpunkt die maximal erreichte Wirkung zur Auswertung.
Bei 27 Patienten (90 %) (13/14) verbesserte sich der Lahmheitsgrad. Zwei Patienten (6,7 %) (2/-)zeigten bei unverändertem Lahmheitsgrad eine Verbesserung der Lebensqualität durch Verminderung der Schmerzen. Vier Hunde (2/2) liefen nach der Bestrahlung vollkommen lahmheitsfrei. Dasheißt, es kam bei 13,3 % zur kompletten Remission von Lahmheit und Schmerz und bei 83,4 % zurpartiellen Remission von Lahmheit und/oder Schmerz. Ein Patient (-/1) erfuhr keine Wirkung durchdie Bestrahlungstherapie (3,3 %). Demnach war bei insgesamt 96,7 % der Patienten eine Wirkungin Form von Verbesserung der Lahmheit und/oder des Schmerzzustandes zu beobachten. DerLahmheitsgrad konnte bei den 27 Patienten um 0,5 bis 2,5 Grad verbessert werden[1,4(1,4/1,4)/1(1,5/1)/0,7281].
4.10 Wirkungsdauer
Bei den 29 Patienten, die eine Wirkung der Bestrahlung erfuhren, hielt diese über einen Zeitraumvon 7-352 Tage an. In Gruppe 1 lagen Minimum und Maximum bei sieben beziehungsweise 236Tagen, in Gruppe 2 bei 36 beziehungsweise 352 Tagen [120(118/122)/99(100/63)]. In dieseDurchschnitts- und Medianwerte ist der Patient aus Gruppe 2, bei dem keine Wirkung eintrat, mitnull Tagen einbezogen.
4.11 Wiederholung von Fraktionen und deren
Ergebnis
Bei drei Patienten der Gruppe 1 wurde eine Fraktion mit 9 Gy wiederholt. Einer der Hunde erfuhrdurch diese zusätzliche Bestrahlung keine Wirkung. Bei den anderen beiden verbesserten sichLahmheit und Schmerzhaftigkeit erneut deutlich. Die schmerzlindernde Wirkung dieser zweitenBestrahlung hielt bei einem Patienten 110 Tage, bei dem anderen Patienten 23 Tage lang an. Indieser kleinen Gruppe hatten die Hunde eine durchschnittliche beziehungsweise mediane Gesamtwirkung von 203 respektive 199 Tagen.
4.12
Gesamtwirkungsdauer
Die
Gesamtwirkungsdauer der Bestrahlung reichte von 7-352 Tagen (7-346/36-352)[124(127/122)/99(100/63)/96,5447].
4.13 Nebenwirkungen
Das mögliche Auftreten von Nebenwirkungen wurde durch die klinischen Kontrollen in derTierklinik und die schriftliche Besitzerbefragung verfolgt. Keines der beiden Protokolle resultiertein klinisch signifikanten lokalen akuten oder chronischen Nebenwirkungen.
4.14 Prognostische Parameter für die Wirkungsdauer
Die
mediane Längenausdehnung des Tumors lag bei 41 % der Länge des betroffenen Knochens. 16Patienten
hatten Tumoren mit einer Längenausdehnung <41 %. Hier wurde eine durchschnittlichebeziehungsweise mediane Wirkungsdauer von 159 beziehungsweise 126 Tagen erreicht. Die Hundemit einer Längenausdehnung von >41 % (n=14) hatten eine durchschnittliche und medianeWirkungsdauer von 84 und 70 Tagen.
Zum Zeitpunkt der ersten Bestrahlung lag der mediane Lyseindex der Knochentumoren bei III.
17Patienten mit einem Lyseindex ≤III hatten eine durchschnittliche beziehungsweise mediane
Dauerder Wirkung von 110 beziehungsweise 84 Tagen. Bei 13 Hunden mit einem Lyseindex >III
konnteeine Wirkungsdauer von durchschnittlich 143 und median 112 Tagen ermittelt
werden.
13 Patienten hatten einen Tumor proximal im Humerus, 17 wiesen andere Tumorlokalisationen
auf.Somit war der Humerus in der vorliegenden Studie der mit Abstand am häufigsten
betroffeneKnochen. Da RAMIREZ und Mitarbeiter (1999) bei Tumoren an dieser Stelle eine längere
Wirkungsdauer verglichen zu Tumoren anderer Lokalisation erzielten, wurden in der vorliegendenStudie ebenfalls Hunde mit Tumoren proximal im Humerus Patienten mit anderen Tumorlokalisationen
gegenübergestellt. Bei Osteosarkomen proximal im Humerus zeigte in der vorliegenden Studiedie
Bestrahlung eine durchschnittliche beziehungsweise mediane Wirkungsdauer von 93 beziehungsweise 67 Tagen. War der Tumor dagegen in einer anderen Lokalisation, betrug die durchschnittliche
beziehungsweise mediane Wirkungsdauer 148 und 123 Tage.
Der mediane Lahmheitsgrad vor Bestrahlung lag bei 2,75 Grad. Patienten (n=15) mit
einemLahmheitsgrad <2,75 hatten eine durchschnittliche beziehungsweise mediane Wirkungsdauer
von156 und 140 Tagen. Hunde (n=15), die mit einem stärkeren Lahmheitsgrad als 2,75
vorgestelltwurden, erfuhren eine Wirkung mit einer Dauer von durchschnittlich 93 und median 77
Tagen.
Hunde (n=18) mit einer Erhöhung der ALKP im Blutserum zeigten eine Verbesserung der Lahmheits-
beziehungsweise Schmerzsituation um durchschnittlich 111 und median 77 Tage. BeiPatienten (n=12)
mit einer ALKP im Referenzbereich lagen diese Werte bei durchschnittlich 144und median 98 Tagen.
Eine Erniedrigung der RBC kam bei 11 Patienten vor. Diese hatten einedurchschnittliche
beziehungsweise mediane Wirkungsdauer von 92 respektive 63 Tagen. DieStudienteilnehmer mit RBC
im Normbereich (n=19) erreichten durchschnittlich 143 und median112 Tage.
Die Patienten mit Muskelatrophie der betroffenen Gliedmaße (n=19) hatten eine
durchschnittlichebeziehungsweise mediane Wirkungsdauer von 133 respektive 114 Tagen. Nur drei
Hunde wurdenohne messbare Muskelatrophie vorgestellt. In dieser kleinen Gruppe lagen der
Durchschnittswertbei 104 Tagen und der Medianwert bei 42 Tagen.
Die mediane Körpermasse betrug 46,5 kg. War die Körpermasse niedriger (n=15), so konnte für
dasAnhalten der Wirkung ein Durchschnittswert von 149 Tagen und ein Medianwert von 137
Tagenerrechnet werden. Lag die Körpermasse bei >46,5 kg (n=15), so erreichten sie 100 Tage
durchschnittliche und 77 Tage mediane Wirkungsdauer.
Um eine Geschlechtsabhängigkeit zu evaluieren, wurden männliche (intakt und kastriert)
undweibliche (intakt und kastriert) Tiere verglichen. Die Rüden (n=14) hatten eine Wirkungsdauer
vondurchschnittlich 119 und median 125 Tagen, die Hündinnen (n=16) von durchschnittlich 129
undmedian 88 Tagen. Unterscheidet man intakte und kastrierte Patienten, so hatten die intakten
Tiere(n=17) eine durchschnittliche beziehungsweise mediane Wirkungsdauer von 139 und 134
Tagen.Die kastrierten Rüden und Hündinnen (n=13) erreichten Werte von durchschnittlich 106
undmedian 63 Tagen.
Das Alter betrug median acht Jahre. Hunde jünger als acht Jahre (n=13) hatten eine
durchschnittliche beziehungsweise mediane Wirkungsdauer von 119 und 98 Tagen. Patienten im Alter von achtJahren oder älter (n=17) erfuhren eine Wirkung über durchschnittlich 130 und median 95 Tage.22 Hunde waren zu Behandlungsbeginn mit Schmerzmitteln vorbehandelt. Diese Patientengruppezeigte durchschnittlich 113 beziehungsweise median 91 Tage eine Verbesserung von Lahmheitund/oder Schmerz. Die acht nicht vorbehandelten Tiere hatten eine durchschnittliche beziehungsweise mediane
Wirkungsdauer von 155 beziehungsweise 161 Tagen.
Betrachtet man die Wirkungsdauer bezüglich der Länge der Vorerkrankung, so hatten Patienten
miteiner Vorerkrankungsdauer unter sieben Wochen (n=15) eine durchschnittliche respektive
medianeWirkungsdauer von 107 beziehungsweise 63 Tagen. Gingen sie länger als sieben Wochen vor
derBestrahlung lahm (n=15), lag die durchschnittliche beziehungsweise mediane Wirkungsdauer
bei142 und 137 Tagen.
Bei sechs Hunden waren am Tag der ersten Bestrahlung noduläre Lungenverschattungen nachweisbar, die als Lungenmetastasen des Osteosarkoms beurteilt wurden. Hier betrug die
durchschnittlicheWirkungsdauer 143 Tage und die mediane 107 Tage. In der Gruppe (n=24), in der
anfangs keineLungenmetastasen nachweisbar waren, lag die durchschnittliche beziehungsweise
medianeWirkungsdauer bei 120 und 105 Tagen.
4.15 Überlebenszeit oder Studiendauer, Gründe für Tod beziehungsweise Studienabbruch
Die Studie galt als beendet, wenn der Patient euthanasiert wurde oder eines natürlichen Todes starb,sowie im Falle einer Gliedmaßenamputation. Die Spanne für die Überlebenszeit beziehungsweisebis zum Abbruch der vorliegenden Studie lag bei 20 bis 378 Tagen (21-378/20-366+)[145(150/139)/137(137/105)95,3934].
19 (11/8)
Patienten wurden aufgrund von Progression der Lahmheit euthanasiert. Bei drei (1/2)Patienten
wurde die betroffene Gliedmaße wegen progressiver Lahmheit, bei einem (-/1) Patientenaufgrund
einer pathologischen Fraktur amputiert. Ein (-/1) Patient verstarb spontan unter akutemAuftreten
von Epistaxis, wobei hierfür ursächlich die seit Therapiebeginn bestehende Lungenmetastasierung vermutet wurde. Ein Patient (-/1) verstarb aufgrund einer Pneumonie. Ein Hund (1/-)wurde wegen schlechtem Allgemeinzustand bei guter Gliedmaßenbelastung euthanasiert. ZweiStudienteilnehmer (2/-) wurden wegen einer pathologischen Fraktur der betroffenen Gliedmaßeeingeschläfert. Zwei (-/2) Patienten zeigten zum Abschlusszeitpunkt der Studie (31.12.04) guteGliedmaßenbelastung. Da diese Patienten bezüglich Wirkungsdauer und Überlebenszeit deutlichüber dem Durchschnitt lagen, haben sie bei der Auswertung der Medianwerte keinen Einfluß.
5 Diskussion
Ziel dieser Arbeit war die Untersuchung, ob eines der zu vergleichenden Protokolle Vorteilehinsichtlich Grad und Dauer der schmerzlindernden Wirkung, Zeitpunkt des Wirkungseintritts undWiederholbarkeit der Behandlung erbringt. Daneben wurden möglicherweise beeinflussendeFaktoren hinsichtlich ihrer prognostischen Aussagekraft überprüft. Hierzu gehörten Längenausdehnung im betroffenen Knochen, Lokalisation des Tumors, Lysegrad, Körpermasse, Alter, Rasse,Geschlecht, Lahmheitsgrad vor der Bestrahlung, Dauer der bestehenden Lahmheit vor Bestrahlung,Vorbehandlung mit Schmerzmittel, Erhöhung der ALKP, Erniedrigung der RBC und Ausmaß derMuskelatrophie der betroffenen Gliedmaße. Die statistische Auswertung erfolgte per Korrelationskoeffizient nach Pearson und wurde mit dem Rangkorrelationskoeffizienten nach Spearmankontrolliert. P-Werte von ≤0,05 wurden als statistisch signifikant angesehen.
5.1 Patientendaten und prognostische
Parameter
5.1.1 Rasse
Die
Population beziehungsweise das Signalement des Patientenkollektivs entspricht dem vergleichbarer Studien. Unter den reinrassigen Hunden waren Rottweiler (6 Patienten), gefolgt von
Doggenund Hovawarts (je 4 Patienten), sowie Bullmastiffs und Riesenschnauzern (je 2 Patienten)
amhäufigsten vertreten. Mit sechs von 30 Hunden waren auch größere Mischlinge häufig
betroffen.Die restliche Population verteilte sich auf verschiedene große Rassen und
Riesenrassen. DiePrädisposition für große Rassen und Riesenrassen wird in zahlreichen
internationalen Publikationenbeschrieben (KIRPENSTEIJN et al. 2003, MISDORP und HART 1979),
wobei die Populationszusammensetzung der einzelnen Studien auch von länderspezifischen Rassepräferenzen abhängig ist.Eine höhere Inzidenz für Doggen und Rottweiler wurde von MISDORP und HART (1979)bestätigt, was genetische Prädispositionen bestimmter Rassen nahe legt. Eine umfassende Studievon RU und Mitarbeitern (1998) zeigte eine stärkere und beständigere Assoziation der Prävalenzdes Tumors mit der Schulterhöhe als mit der Körpermasse der Hunde. Die Schulterhöhe derPatienten wurde im vorliegenden Patientengut nicht bestimmt.
5.1.2 Alter
Das Alter der Patienten reichte von drei bis 12 Jahren mit einem Durchschnitts- respektive Medianwert von 7,9 beziehungsweise acht Jahren. Diese Verteilung entspricht Angaben aus der Literatur, nach der vor allem Hunde mittleren und höheren Alters mit einem Durchschnittsalter zwischensechs und acht Jahren betroffen sind (MISDORP und HART 1979, OWEN und STEVENSON1961, TJALMA 1966). Hunde jünger als acht Jahre (n=13) hatten eine durchschnittliche beziehungsweise mediane Wirkungsdauer der Schmerzreduktion von 119 und 98 Tagen. Patienten miteinem Alter von acht Jahren oder älter (n=17) erfuhren eine Wirkung über durchschnittlich 130 undmedian 95 Tage. Zwischen beiden Altersgruppen fand sich hinsichtlich der Wirkungsdauer keinstatistisch relevanter Unterschied (p=0,780), so dass das Alter nicht als prognostischer Parameteridentifiziert wurde.
5.1.3 Geschlecht
Die
Patientengruppe setzte sich aus 16 weiblichen (davon 11 kastriert) und 14 männlichen (davon 2kastriert) Hunden zusammen. Die in der Literatur gelegentlich beschriebene Prädisposition fürmännliche Tiere (DERNELL et al. 2001), die mit der bei männlichen Individuen höheren Körpermasse
beziehungsweise Körpergröße zusammenhängen könnte, wurde nicht bestätigt. Allerdings istdie
geringe Patientenzahl der vorliegenden Studie nicht geeignet, eine Geschlechtsprädispositionstatistisch zu überprüfen. Auch ein bevorzugtes Vorkommen bei kastrierten Tieren (RU et al.
1998)lag im vorliegenden Patientenkollektiv nicht vor. Die Rüden (n=14) hatten eine
Wirkungsdauer vondurchschnittlich 119 und median 125 Tagen, die Hündinnen (n=16) von
durchschnittlich 129 undmedian 88 Tagen. Wurde die Wirkungsdauer in Bezug auf den
Kastrationsstatus der Patientenuntersucht, so hatten intakte Tiere (n=17) durchschnittliche
beziehungsweise mediane Wirkungsdauern von 139 und 134 Tagen. Die kastrierten Patienten (n=13) erreichten Werte von durchschnittlich 106 und median 63 Tagen. Die Unterschiede in der Wirkungsdauer
waren statistisch nichtrelevant (p=0,094 für m : w, p=0,118 für mk,wk : m,w).
5.1.4 Körpermasse
Am Tag der ersten Bestrahlung wogen die Tiere 24 bis 85 kg, im Mittel 48,2 kg (49,7/46,7). DerMedianwert betrug 46,5 kg (45,6/50). Die Körpermasse der Patienten entspricht dem Patientengutanderer Studien zur palliativen Bestrahlung von Osteosarkomen. MCENTEE und Mitarbeiter(1993) und RAMIREZ und Mitarbeiter (1999) beschrieben eine Spanne an Körpermasse von 23 bis91 kg respektive 24,9 bis 62,9 kg mit einem Medianwert bei 41,7 kg respektive 45,5 kg. In dervorliegenden Studie konnte bei Patienten mit einer Körpermasse unter 46,5 kg (n=15) für dieschmerzstillende Wirkung der Bestrahlung eine durchschnittliche beziehungsweise medianeWirkungsdauer von 149 und 137 Tagen ermittelt werden. Lag die Körpermasse über 46,5 kg(n=15), wurden 100 beziehungsweise 77 Tage erreicht. Die Unterschiede in der Wirkungsdauerwaren statistisch nicht signifikant (p=0,433).
5.1.5
Tumorlokalisation
Die
Vordergliedmaße (19 Patienten) war 1,7-mal häufiger betroffen als die Hintergliedmaße (11Tumoren). Andere Autoren beschreiben Häufigkeitsverhältnisse von Vorder- zu Hintergliedmaßevon 1,6 : 1 (WOLKE und NIELSEN 1966), 2,1 : 1 (MISDORP und HART 1979) und sogar 3 : 1(PONOMARKOV 1983). Die Prädisposition der Vordergliedmaßen wird dadurch erklärt, dass etwaZweidrittel der Körpermasse von den Vorderextremitäten getragen wird.
Im Bereich der Vordergliedmaßen war der Tumor vor allem in der proximalen
Humerusmetaphyse(13 Tumoren=43,3 %) und der distalen Radiusmetaphyse (4 Tumoren=13,3 %) zu
finden. ZweiNeoplasien (6,7 %) entstanden proximal in der Ulna. In der Hintergliedmaße fanden
sich dieTumoren distal in der Tibia (5 Tumoren=16,7 %), distal im Femur (3 Tumoren=10 %),
proximal inder Tibia (2 Tumoren=6,7 %) und in der Femurdiaphyse (1 Tumor=3,3 %). Diese
Lokalisationsverteilung entspricht im Wesentlichen den Literaturangaben (KNECHT und PRIESTER 1978,MISDORP und HART 1979, 0`BRIEN et al. 1993, WOLKE und NIELSEN 1966).KNECHT und PRIESTER (1978) beschrieben die Verteilung von muskuloskeletalen Tumorenbeim Hund und gaben für das canine appendikulare Osteosarkom folgende Prozentzahlen an:Humerus proximal (18 %), Radius distal (30 %), Ulna distal (8,5 %), Femur distal (13 %), Tibiaproximal (13 %) und Tibia distal (6,5 %). Die Unterschiede in der vorliegenden Studie hierzu
sindam ehesten durch die verhältnismäßig kleine Patientengruppe zu erklären.
Zur Auswertung als möglicher prognostischer Parameter hinsichtlich der Schmerzreduktion wurdedie Tumorlokalisation in (proximaler) Humerus (n=13) und andere Lokalisationen (n=17) eingeteilt,da zum einen der Humerus in der vorliegenden Studie die mit Abstand häufigste Lokalisationdarstellte und zum anderen RAMIREZ und Mitarbeiter (1999) bei Tumoren an dieser Stelle übereine längere Wirkungsdauer der Bestrahlung berichteten. Andere Studien zur palliativen Bestrahlung von appendikularen Osteosarkomen haben bezüglich der Tumorlokalisation keine Unterschiede in der Wirkung beschrieben (BATEMAN et al. 1994, GREEN et al. 2002, KLEITER et al. 2002,MCENTEE et al. 1993). KRASTEL und Mitarbeiter (2006) haben bei Osteoarkomen im Humerusim Vergleich zu Läsionen distal im Radius eine deutlich kürzere Wirkungsdauer durch die Bestrahlung gefunden. Bei Amputation mit adjuvanter Chemotherapie wurde die Lokalisation im Humerusbereits als prognostisch negativer Faktor beschrieben. Als Ursache dafür vermutet man, dassTumoren im Humerus häufig vor Diagnosestellung ein größeres Tumorvolumen erreichen (LIPTAK et al. 2004). Ein unterschiedliches biologisches Verhalten von Osteosarkomen proximal imHumerus im Vergleich zu anderen Lokalisationen wird an keiner Stelle publiziert.
Hunde mit Osteosarkomen im Bereich der proximalen Humerusmetaphyse hatten in der vorliegenden Untersuchung eine durchschnittliche beziehungsweise mediane Wirkungsdauer von 93 und 67Tagen. In anderen Lokalisationen betrug die durchschnittliche beziehungsweise mediane Wirkungsdauer 148 und 123 Tage. Patienten mit einem Tumor im Humerus schnitten tendenziellschlechter ab. Dieser Unterschied erwies sich als statistisch nicht signifikant (p=0,15). Deshalb wirdnicht davon ausgegangen, dass die vorliegenden Untersuchungen davon beeinflusst wurden, dass inGruppe 2 verglichen zu Gruppe 1 mehr Osteosarkome im Humerus lokalisiert waren.
5.1.6 Lahmheitsgrad
Die
Lahmheit am ersten Bestrahlungstag wurde gemäß Anhang 2 in vier Grade eingeteilt. Derdurchschnittliche und mediane Lahmheitsgrad betrug 2,6 (2,5/2,7) beziehungsweise 2,75 (2,5/3).Dabei waren in dem vorliegenden Patientenkollektiv alle Lahmheitsgrade von 1-4 vertreten. ZweiPatienten waren unter Gabe von Schmerzmittel kurzfristig ohne Lahmheit, zeigten an manchenTagen jedoch eine deutliche Lahmheit. Bei den von RAMIREZ und Mitarbeitern (1999) untersuchten 95 Hunden mit
appendikularem Osteosarkom wurden 73,7 % als lahm, aber gewichtstragendund 26,3 % als nicht
gewichtstragend befundet. Auch MCENTEE und Mitarbeiter (1993) unterschieden bei den 15 Hunden nur zwischen „lahm mit Belastung der Gliedmaße“ (60 %), „keineGliedmaßenbelastung in der Bewegung“ (26,7 %) und „keine Gliedmaßenbelastung im Stand“(13,3 %). Eine Lahmheitseinteilung nach genauer definierten Graden erfolgte in beiden Studiennicht.
KLEITER und Mitarbeiter (2002) befundeten bei sechs Hunden vor Bestrahlung Stützbeinlahmheiten der Grade 2-3. Bei BATEMAN und Mitarbeitern (1994) wurde die Lahmheit in Grade 0 für„keine Lahmheit“ bis 3 für „keine Belastung“ eingeteilt. Die Auswertung erfolgte jedoch nichtgetrennt von der Bewertung für Appetit und Aktivität. Sie ermittelten aus allen drei Parameterneinen Gesamtwert pro Patient vor und nach Bestrahlung.
Auch wenn die Ergebnisse aus den publizierten Studien aufgrund von unterschiedlichen Bewertungssystemen nicht unmittelbar mit den vorliegenden vergleichbar sind, so erscheinen die Resultate der Lahmheitsauswertung doch sehr ähnlich. Auch in anderen Literaturangaben zur Klinik vonOsteosarkomen (KIPENSTEIJN 2003, NAGEL 2000) wird von meist deutlichen Lahmheitenberichtet.
Patienten (n=15) mit einem Lahmheitsgrad <2,75 (Medianwert) hatten eine durchschnittlichebeziehungsweise mediane Wirkungsdauer der Schmerzreduktion von 156 und 140 Tagen. Bei den15 Hunden, deren Lahmheitsgrad über 2,75 lag, hielt die Wirkung durchschnittlich 93 und median77 Tage an. Patienten mit einem geringeren Lahmheitsgrad zu Bestrahlungsbeginn schnittentendenziell besser ab. Dieser Zusammenhang war gemäß dem Pearson-R Signifikanztest mit einemP von 0,052 schwach signifikant. Es erscheint erstrebenswert, die Patienten schon bei geringemLahmheitsgrad zu bestrahlen. Zum einen wird tendenziell eine längere Wirkungsdauer beobachtet,zum anderen möchte man den Patienten sofern möglich natürlich auch Phasen mit starken Schmerzen ersparen.
5.1.7 Appetit und
Aktivität
Zur
Beurteilung der Lebensqualität wurden die Besitzer neben dem Lahmheitsgrad auch zu Appetitund
Aktivität befragt. Beides wurde ebenfalls gemäß Anhang 2 in Grade zwischen 0 und 3 eingestuft. Der Appetit lag bei allen 30 Patienten zwischen 0 und 1, im Durchschnitt bei Grad 0,13(0,07/0,2), die Aktivität zwischen 0 und 3 im Durchschnitt bei Grad 1 (1/1). Das heißt, der
Appetitwar nur in einigen wenigen Fällen geringgradig reduziert, die Aktivität hingegen meist
vermindert,wenn auch nur geringgradig. Die Lebensqualität konnte demnach bei der Mehrheit der
Patienten,abgesehen vom tumorassoziierten Schmerz, als gut beurteilt werden.
In den Untersuchungen von GREEN und Mitarbeitern (2002), KLEITER und Mitarbeitern
(2002),MCENTEE und Mitarbeitern (1993) und RAMIREZ und Mitarbeitern (1999) wurden
keineAngaben zu Appetit und Aktivität gemacht. BATEMAN und Mitarbeiter (1994) teilten Appetit
undAktivität ebenfalls nach Grad 0 (normal) bis 3 (Inappetenz/nur Aktivität zum Urin- und
Kotabsatzin kurzer Distanz) ein. Da jedoch nur sechs der 24 Hunde dieser Studie ein
appendikulares Osteosarkom hatten, ist ein Vergleich mit den vorliegenden Ergebnissen kaum aussagekräftig.
5.1.8 Lahmheitsdauer
Die Lahmheit der betroffenen Gliedmaße vor Therapiebeginn bestand seit zwei bis 54 Wochen,durchschnittlich 13,1 (11,2/14,9) beziehungsweise median sieben Wochen (9/6). RAMIREZ undMitarbeiter (1999) fanden eine Spanne von drei Tagen bis 24 Monaten (median 30 Tage), MCENTEE und
Mitarbeiter (1993) von zwei Wochen bis vier Monaten (im Mittel 1,4 Monate, median 1Monat,) und
KLEITER und Mitarbeiter (2002) von zwei bis sechs Wochen. Die Durchschnitts- undMedianwerte der
vorliegenden Studie liegen etwas, jedoch nicht deutlich höher als bei den genannten Studien. Der höhere Durchschnittswert kann dadurch zustande gekommen sein, dass wegen derrelativ kleinen Patientenzahl die beiden Patienten mit 54 Wochen Vorerkrankungsdauer stärker insGewicht gefallen sind.
Betrachtet man die Wirkungsdauer bezüglich der Länge der Lahmheitssymptome vor der Vorstellung, so hatten Patienten mit einer Vorerkrankungsdauer <7 Wochen (n=15) eine durchschnittlicherespektive mediane Wirkungsdauer der Schmerzreduktion von 107 beziehungsweise 63 Tagen.Bestand die Lahmheit bereits länger als sieben Wochen vor der Bestrahlung (n=15), lag diedurchschnittliche beziehungsweise mediane Wirkungsdauer bei 142 und 137 Tagen. Bei Patientenmit längerer Vorerkrankung wurde somit eine länger anhaltende Wirkung erzielt. Diese Unterschiede waren statistisch signifikant (p=0,0079).
Betrachtet man die Patienten mit längerer Vorerkrankung als eigene Gruppe, so entsprechenLysegrad, prozentuale Knochenbeteiligung und Lahmheitsgrad den Durchschnittswerten für dieGesamtgruppe. Man könnte postulieren, dass Lahmheiten, die sich langsamer entwickelt haben unddeshalb auch schon länger bestanden haben, an Tumoren gekoppelt sind, die langsamer wachsen,und es deshalb erst nach einem längeren Zeitraum nach Bestrahlung wieder zu Schmerz undLahmheit kommt.
5.1.9 Vorbehandlung mit
Analgetika
17
Patienten (7/10) waren mit einem NSAID und fünf Hunde (2/3) mit einer Kombination auseinem NSAID
und einem Glukokortikoid vorbehandelt worden. Lediglich acht Patienten (6/2)hatten vor der
Bestrahlungsbehandlung kein Schmerzmittel erhalten. Somit hatten 73,3 % derPatienten orale
Analgetika bekommen. Es gab unterschiedliche Gründe, in Einzelfällen kein oralesAnalgetikum zu
verabreichen. So waren bei einigen Hunde bei vorherigen Gaben Nebenwirkungenaufgetreten. Andere
Besitzer bevorzugten eine sofortige Bestrahlung, da die Wirkungsdauer oral zuverabreichender
Analgetika bekanntermaßen nur von sehr begrenzter Dauer ist (KIRPENSTEIJN2004, LIPTAK et al.
2004).
Von den Patienten aus der Studie von RAMIREZ und Mitarbeitern (1999) hatten 68,4 % unterschiedliche orale Analgetika, vor allem NSAIDs, erhalten. 3,2 % waren ohne derartige Medikamente belassen worden, und bei 28,4 % wurden hierzu keine Angaben gemacht. Die sechs Hunde ausder Studie von KLEITER und Mitarbeitern (2002) erhielten alle NSAIDs (Carprofen oder Piroxicam), einem wurde zusätzlich ein Morphiumpräparat (Tramadolhydrochlorid) verabreicht.
Bei
BATEMAN und Mitarbeitern (1994) wurden 30 % der Patienten zu Beginn der Strahlentherapie mit oralen Analgetika behandelt. Für diese Studie gilt es zu bedenken, dass nur sechs Hunde
einOsteosarkom der Extremitäten hatten. Patienten mit anderen behandelten Tumoren (zum
BeispielWeichteilsarkome, orale Melanome) zeigen generell weitaus seltener offensichtliche
Schmerzen.Die 22 mit Schmerzmittel vorbehandelten Hunde der vorliegenden Studie zeigten nach der
Bestrahlung über durchschnittlich 113 beziehungsweise median 91 Tage eine Verbesserung von Lahmheitund/oder Schmerz. Die acht nicht vorbehandelten Tiere hatten mit einer durchschnittlichen beziehungsweise
medianen Wirkungsdauer von 155 beziehungsweise 161 Tagen tendenziell, jedochstatistisch nicht
signifikant (p=0,372), bessere Ergebnisse als vorbehandelte Tiere.
5.1.10 Muskelatrophie
19 Patienten (9/10) wurden mit einer Muskelatrophie vorgestellt. Bei drei Hunden (1/2) hatten beideGliedmaßen den gleichen Umfang. Acht Hunde (5/3) konnten bezüglich dieses Parameters nichtausgewertet werden. Die durchschnittliche Abweichung betrug -1,05 cm (-0,9 cm/-1,2 cm) an derbetroffenen Gliedmaße. Die Atrophie der Gliedmaßenmuskulatur ist ein objektiv auszuwertenderParameter als Spiegel der schmerzbedingten Schonung der betroffenen Extremität, wenngleichvorbestehende Muskelatrophien aufgrund nicht tumorassoziierter (orthopädischer) Erkrankungensowie individuelle Unterschiede in der Schmerzempfindlichkeit diesen Parameter beeinflussenkönnen.
Nur bei MCENTEE und Mitarbeitern (1993) findet sich eine Angabe über eine Muskelatrophie bei4
von 15 Patienten, während bei den anderen 11 von einer derben Schwellung berichtet wird.Obgleich
nicht explizit erwähnt, ist aus diesen Angaben zu schließen, dass der Gliedmaßenumfanghier im
Bereich des Tumors gemessen wurde. Die Ergebnisse der vorliegenden Studie wurdendurch Messung
des Muskelumfanges proximal des Tumors ermittelt.
Die Patienten mit Muskelatrophie (n=19) hatten eine durchschnittliche beziehungsweise
medianeWirkungsdauer der Bestrahlung von 133 respektive 114 Tagen. Nur drei Hunde wurden
ohnemessbare Muskelatrophie vorgestellt. In dieser kleinen Gruppe lag der Durchschnittswert bei
104Tagen und der Medianwert bei 42 Tagen. Aufgrund der geringen Anzahl an Hunden ohne
Muskelatrophie ist dieser Wert nicht im Sinne eines prognostischen Parameters statistisch auswertbar. EinZugewinn an Muskelmasse nach erfolgreicher Bestrahlungstherapie könnte zukünftig als Gradmesser für die
Schmerzreduktion beziehungsweise verbesserte Gliedmaßenfunktion genutzt werden.Dies wurde jedoch
in der vorliegenden Studie und in den zuvor publizierten Untersuchungen nichtberücksichtigt.
5.1.11 Tumorlängenausdehnung im Knochen
Der prozentuale Anteil der durch den Tumor betroffenen Knochenlänge wurde per mediolateralerRöntgenaufnahme vermessen. Die dabei ermittelten Werte lagen zwischen 16,3 % und 83,3 % derKnochenlänge. Im Durchschnitt waren 39,1 % (36,0 %/42,2 %) und median 41 % (41,2 %/34,6 %)des Knochens vom Tumor betroffen. Um die Ergebnisse mit denen anderer Autoren (GREEN et al.2002, MCENTEE et al. 1993, RAMIREZ et al. 1999) vergleichen zu können, wurde in Anlehnungan deren Studien als Grenze für den prognostischen Parameter der Medianwert (41 %) gewählt.Zur Berechnung wurde die Gesamtwirkungsdauer inklusive Wiederholungsbestrahlung und derPatient ohne Wirkung mit null Tagen herangezogen. Die Wirkungsdauer der Bestrahlung beiPatienten mit einer prozentualen Knochenbeteiligung von <41 % (n=16) lag bei durchschnittlich159 Tagen (148/174), median bei 126 Tagen (112/140). Für Patienten mit einer prozentualenKnochenbeteiligung von >41 % (n=14) betrugen die Durchschnittswerte für die Dauer der Wirkung84 Tage (94/77), die Medianwerte 70 Tage (88/55). Dieser Befund war mit p=0,054 statistischschwach signifikant.
In der Untersuchung von GREEN und Mitarbeitern (2002) (24 Hunde) hatten Patienten mit
wenigerals 42 % Knochenbeteiligung eine mediane Wirkungsdauer von 220 Tagen. Bei größerer
Tumorausdehnung lag die Wirkungsdauer bei nur 52,5 Tagen. Dieser Unterschied war jedoch statistischnicht signifikant. Auch MCENTEE und Mitarbeiter (1993) (15 Hunde) konnten einen statistischenZusammenhang zwischen prozentualer Längenausdehnung des Tumors und der Wirkungsdauer derBestrahlung nicht nachweisen. Lediglich RAMIREZ und Mitarbeiter (1999) fanden einen statistischsignifikanten Unterschied. Hier war die mediane Dauer der Wirkung bei einer Tumorausdehnungunter 42 % der Knochenlänge statistisch signifikant länger.
5.1.12 Lyseindex
Der Typ der Knochenveränderung wurde gemäß Tabelle 13 in Anlehnung an das von RAMIREZund Mitarbeitern (1999) benutzte Einteilungsschema bestimmt. Drei Patienten (2/1) wurden alsIndex I, sechs Patienten (3/3) als Index II, acht Patienten (4/4) als Index III, zehn Patienten (6/4)
alsIndex IV und drei Patienten (-/3) als Index V bewertet. Diese Verteilung zeigt, dass der
Anteil anLyse und Proliferation sehr unterschiedlich war, die meisten Patienten (n=24, 80 %)
jedochgemischte Veränderungen aus Lyse und Proliferation aufwiesen. Bei nur jeweils 10 % der
Hundewaren die Veränderungen ausschließlich lytisch beziehungsweise proliferativ.
Für Tumoren mit Lyseindex I und II konnte eine durchschnittliche beziehungsweise
medianeWirkungsdauer der Bestrahlung von 143 beziehungsweise 137 Tagen, für Index III 92
beziehungsweise 63 Tagen und für Index IV und V 162 beziehungsweise 112 Tagen ermittelt werden. Patienten mit Index I und II beziehungsweise IV und V wurden zusammengefasst, um eine
auswertbareGruppengröße zu erreichen. Zum Zeitpunkt der ersten Bestrahlung lag der mediane
Lyseindex derTumoren der vorliegenden Studie bei III. Die 17 Patienten mit einem Lyseindex ≤III
hatten einedurchschnittliche beziehungsweise mediane Wirkungsdauer von 110 beziehungsweise 84
Tagen.Bei den Hunden (n=13) mit einem Lyseindex >III konnte eine Wirkungsdauer von
durchschnittlich143 und median 112 Tagen ermittelt werden. Statistisch war der Lyseindex zu
Bestrahlungsbeginnfür die Dauer der Schmerzlinderung nicht signifikant (p=0,998).
Bei RAMIREZ und Mitarbeitern (1999) wurden fünf Läsionen als Index I, 23 als Index II, 14
alsIndex III, 37 als Index IV und eine als Index V eingestuft, womit auch hier der Schwerpunkt
beigemischt lytisch-proliferativen Veränderungen lag. Die mediane Wirkungsdauer lag für Grad I
undII zusammen bei 10 Tagen, für Grad III bei 49 Tagen und für Grad IV und V bei 46 Tagen.
Dasschlechtere Abschneiden von lytischen Läsionen war auch bei RAMIREZ und Mitarbeitern
(1999)in der Multivarianzanalyse nicht statistisch signifikant.
Der in der vorliegenden Untersuchung bei Lyseindex I und II bessere Medianwert für die
Wirkungsdauer könnte in der sehr langen Wirkungsdauer bei individuellen Patienten begründet liegen,die aufgrund der geringen Patientenzahlen stärker ins Gewicht fallen. Es ist jedoch tatsächlichdenkbar, dass der Lysegrad des Knochens prognostisch unbedeutend ist. Als Folge der Bestrahlunglassen sich circa zwei Wochen nach der Behandlung gewisse Rekalzifizierungs- und Reparaturprozesse
osteolytischer Läsionen nachweisen (MCENTEE et al. 1993, POULSEN et al. 1989).
Wächst der Tumor langsamer, als diese Reparaturvorgänge ablaufen, können diese Prozesse zurStabilisierung des Knochendefektes beitragen, so dass sich damit das erhöhte Frakturrisiko lytischerLäsionen wieder relativiert. Im Vergleich zu lytischen Veränderungen ist bei Tumoren mit hohemLyseindex (stark proliferative Veränderungen) zwar eine bessere statische Belastbarkeit anzunehmen, die dauerhafte Reizung des umgebenden Weichteilgewebes durch die Knochenproliferationenkönnte sich im Gegenzug jedoch nachteilig auf die Dauer der Schmerzlinderung auswirken.
5.1.13 Noduläre Lungenverschattungen
Am Tag
des Behandlungsbeginnes konnten bei sechs Patienten (2/4) sowohl röntgenologisch alsauch per
Computertomographie noduläre Lungenveränderungen nachgewiesen werden. Fürnoduläre
Lungenveränderungen kommen differenzialdiagnostisch granulomatöse Erkrankungen,primäre und
metastatische Neoplasien, Abszesse, Zysten, Hämatome, Lungenwürmer, Dirofilarioseoder
Broncholithiasis in Frage (MORGAN 1988). Es wurde davon ausgegangen, dass es sich beiden
nodulären Lungenveränderungen um Metastasen des Knochentumors handelt, da bei keinemder
Patienten Hinweise auf eine andere mögliche Ursache bestanden. Damit stellten Lungemetastasen des Osteosarkoms die wichtigste und wahrscheinlichste Differenzialdiagnose dar. Eine histologische
Bestätigung des Verdachts post mortem war nicht möglich, da die Besitzer der Hunde miteiner
Sektion nicht einverstanden waren. In der Literatur wird angegeben, dass man bei ca. 10 %aller
Osteosarkompatienten zum Zeitpunkt der Diagnose makroskopisch Metastasen in der Lungenachweisen
kann (DERNELL et al. 2001). Diese Angaben entsprechen den in der vorliegendenStudie gefundenen
Ergebnissen.
Bei drei Patienten wurden im Rahmen der CT zwei respektive drei zusätzliche Metastasen zu den inder Röntgenuntersuchung auffälligen Veränderungen erkannt. Röntgenaufnahmen lieferten guteInformation über das Vorliegen einer makroskopischen Lungenmetastasierung. Kein Patient mitcomputertomographisch nachweisbaren Rundherden der Lunge wäre anhand der röntgenologischenBefunde falsch negativ befundet worden.
Im Rahmen der röntgenologischen Verlaufsuntersuchungen des Thorax konnte bei drei
dieserPatienten eine Zunahme von Größe und/oder Zahl der Lungenveränderungen nachgewiesen
werden.Nur ein Hund wurde (bei guter Gliedmaßenbelastung) aufgrund der Lungenmetastasen
euthanasiert.Bei den übrigen zwei Patienten mit fortschreitender und den drei Hunden mit
stagnierenderMetastasierung limitierte die Progression des lokalen Tumors die
Überlebenszeit.
Ein Patient aus Gruppe 1, der zum Zeitpunkt des Behandlungsbeginns röntgenologisch und
durchdie CT als makroskopisch metastasenfrei eingestuft wurde, entwickelte fünf Monate nach
Beginnder Bestrahlung Lungenmetastasen. Er musste aufgrund schlechten Allgemeinbefindens trotz
guterGliedmaßenbenutzung euthanasiert werden. Knochenmetastasen und Metastasen in
anderenOrganen konnten bei den Patienten der vorliegenden Studie nicht nachgewiesen werden,
allerdingswurde keiner der Patienten im Rahmen einer Sektion untersucht. Klinische Anzeichen
nichtpulmonärer Fernmetastasen bestanden bei keinem der Patienten. In den Untersuchungen
vonGREEN und Mitarbeitern (2002) hatten zu Behandlungsbeginn sechs von 24 Patienten nachweisbare
Metastasen in Lunge, Knochen und/oder der Unterhaut. Zehn Hunde entwickelten im Studienverlauf Metastasen und insgesamt acht mussten wegen der metastatischen Erkrankung euthanasiertwerden.
In den Untersuchungen von RAMIREZ und Mitarbeitern (1999) hatten 14 von 95 Hunden Metastasen zum
Start der Radiotherapie. Hier wurde nur vermerkt, dass insgesamt 75 Patienten austumorassoziierten Gründen euthanasiert wurden. Es wurde nicht unterschieden, ob Primärtumoroder Metastasen ursächlich für diese Entscheidung waren. In einer anderen Studie konnten anfangskeine Sekundärherde festgestellt werden. Vier Hunde entwickelten jedoch Lungenmetastasen nach1,5 bis 7 Monaten, die bei zwei Tieren den Euthanasiegrund darstellten. Drei weitere Hunde indieser Studie erkrankten an Knochenmetastasen, die dann ebenfalls schmerzbedingt zur Euthanasieführten (MCENTEE et al. 1993).
Die sechs Hunde aus der Studie von KLEITER und Mitarbeitern (2002) waren zu Behandlungsbeginn
makroskopisch metastasenfrei. Vier dieser sechs Patienten entwickelten nach 210 bis 300Tagen
Metastasen, die dann bei zwei Hunden alleiniger Grund für die Euthanasie waren. Bei denbeiden
anderen Patienten trugen eine pathologische Fraktur der Gliedmaße und der Nachweis vonLungenmetastasen gemeinsam zu dieser Entscheidung bei. Drei Studien geben die Todesursachedifferenziert an. Zusammengefaßt waren bei 33,3 % der Patienten Metastasen, bei 42,2 % dieProgression oder Fraktur des Primärtumors und bei 24,5 % andere Ursachen der Grund für eineEuthanasie (GREEN et al. 2002, KLEITER et al. 2002, MCENTEE et al. 1993).
Hunde mit nachweisbaren Metastasen zu Beginn der Bestrahlung (n=6) hatten eine durchschnittliche
und mediane Wirkungsdauer der Bestrahlung von 143 beziehungsweise 107 Tagen. In derGruppe ohne
nachweisbare Lungenmetastasen (n=24) lag die durchschnittliche beziehungsweisemediane
Wirkungsdauer bei 120 und 105 Tagen. Da kein statistisch nachweisbarer Unterschiedzwischen
beiden Gruppen bestand (p=0,687), war das Vorliegen von Lungenmetastasen zuBehandlungsbeginn
kein negativ prognostischer Faktor. Es sollte daher kein Ausschlusskriteriumfür eine palliative
Therapie darstellen.
Dass vor allem in den zuvor publizierten Studien ein relativ hoher Anteil der Patienten
aufgrundvon Metastasen verstarb oder euthanasiert wurde, lässt den Einsatz einer adjuvanten
Chemotherapiesinnvoll erscheinen. Der adjuvante Einsatz von Chemotherapie bei der palliativen
Bestrahlung vonKnochentumoren wurde im Rahmen von zwei Studien untersucht. GREEN und Mitarbeiter
(2002)verabreichten sechs Hunden zusätzlich zur Bestrahlung Carboplatin, wobei jedoch keine
statistischmessbare Verbesserung hinsichtlich Beginn und Dauer der Wirkung ermittelt werden
konnte. Dreiweitere Patienten erhielten im Anschluss an die Bestrahlung eine Chemotherapie, zwei
davon inForm einer experimentellen inhalativen Applikationsform, wobei sich auch hier keine
Verbesserungder Überlebenszeit ergab.
RAMIREZ und Mitarbeiter (1999) applizierten bei 47 der 95 Hunde eine Chemotherapie
zusätzlichzur Bestrahlung. 24 Patienten wurden mit Carboplatin, 20 mit Cisplatin und zwei mit
einer Kombination aus Carbo- und Cisplatin therapiert. Sie konnten bei einem Hund das verwendete Chemotherapeutikum nicht ermitteln. Diese 47 Hunde zeigten eine statistisch nachweisbare höhere
Ansprechrate und längere Wirkungsdauer. Die widersprüchlichen Ergebnisse der Literatur können angesichtsder großen Variabilität der Wirkungszeiten der Bestrahlungstherapie durch die geringen
Fallzahlender zitierten Studien begründet sein, was die Notwendigkeit weiterer Untersuchungen
unterstreicht.In Fortführung der vorliegenden Studie erscheint es daher wünschenswert, die
Ergebnisse beialleiniger palliativer Bestrahlung mit denen einer Kombination mit Chemotherapie
oder einerKombination der Bestrahlung mit Chemotherapie und Bisphosphonaten zu vergleichen.
Einderartiges Anschlussprojekt wird augenblicklich in der Tierklinik Hofheim
durchgeführt.
Vor allem die Kombination einer Radiotherapie mit Chemotherapie und Bisphosphonaten erscheintbei
caninen Osteosarkomen aus zweierlei Gründen sinnvoll. Zahlreiche Untersuchungen habenbereits die
Fähigkeit verschiedener Chemotherapeutika zur Verzögerung der Metastasierung unddamit
Verlängerung der Überlebenszeit belegt (BERG et al. 1995, BERGMAN et al. 1996,DERNELL et al.
1997, SPODNICK et al. 1992). Aus der Humanmedizin ist schon seit über 20Jahren bekannt, dass
Platinderivate (Cisplatin, Carboplatin) die Wirkung einer Strahlentherapiepotenzieren können.
Diese Wirkung beruht im Wesentlichen auf zwei wichtigen Interaktionen.Wird das Platinderivat vor
der Bestrahlung appliziert, so dass es zum Zeitpunkt der Strahlenexposition im Gewebe vorliegt, kommt es zur Radiosensitivierung hypoxischer und somit strahlenresistenter Zellen. Bei Applikation
nach der Bestrahlung verhindert es die Reparatur potentiell letaler odersubletaler Zellschäden
(DOUPLE et al. 1985).
Bisphosphonate werden in der Humanonkologie zur Therapie maligner Hyperkalzämie, Verhinderung
von Knochenmetastasen und schmerzhaften Knochenläsionen eingesetzt. Insbesondere derletzte
Ansatzpunkt ist für die Therapie caniner Osteosarkome interessant und wird zunehmendgenutzt (FAN
et al. 2007, MILNER et al. 2004, TOMLIN et al. 2000). Weitere Untersuchungenhaben zudem gezeigt,
dass vor allem das Bisphosphonat Pamidronate einen wachstumshemmendenEffekt auf humane und
murine Osteosarkomzellen in vitro hat, was seinen Einsatz auch beimMenschen bei primären
Knochentumoren interessant macht (MACKIE et al. 2001, SONNEMANNet al. 2001).
5.1.14 Erhöhung der ALKP und Erniedrigung der RBC
Die Erstellung eines Blutbildes und einer klinischen Chemie sind bei caninen
Osteosarkompatientenvor allem im Hinblick auf Begleiterkrankungen wichtig. Diese können
entscheidend für dieAuswahl der optimalen Therapie sein und zusätzliche Behandlungen notwendig
machen. Diehäufigsten Veränderungen der Laborwerte in der vorliegenden Patientengruppe waren
eine Erhö-hung der Alkalischen Phosphatase bei 18 Hunden (9/9) und eine Erniedrigung der
Erythrozytenzahlbei 11 Patienten (7/4). Damit hatten 60 % der Patienten eine Erhöhung der ALKP
und 36,7 % eineAnämie.
nge-newline"> Die erniedrigten Werte für die RBC bewegten sich im Bereich von 5,04 bis 5,9
T/l (untere Grenzedes Referenzbereichs 6,0 T/l). Anämie ist bei vielen Tumorerkrankungen ein
paraneoplastischesSyndrom. Sie kann durch verschiedene Mechanismen, wie zum Beispiel durch
Blutverlust,immunbedingte oder mikroangiopathische Hämolyse oder chronisch-entzündliche
Prozesse,ausgelöst werden. Anämie ist jedoch nicht spezifisch für canine Osteosarkome und lag
bei keinemder Patienten in einem lebensbedrohlichen Bereich. Die Patienten mit Erniedrigung der
RBCZahlen (n=11) hatten eine durchschnittliche beziehungsweise mediane Wirkungsdauer der Bestrahlung von 92 respektive 63 Tagen. Die übrigen Patienten (n=19) erreichten Werte von durchschnittlich
143 und median 112 Tagen. Dieser Unterschied war statistisch nicht signifikant (p=0,133).Bei
Patienten mit Erhöhungen der ALKP lagen die Werte zwischen 117 und 969 U/L (Referenzbereich des Labors bis 108 U/l). Erhöhungen der ALKP im Serum von Hunden mit Osteosarkom sindin der Literatur mehrfach beschrieben worden (ERHART et al. 1998, GARZOTTO et al. 2000,KIRPENSTEIJN et al. 2002). Erhöhte ALKP-Werte bei Patienten mit Osteosarkomen, ein Rückgang der Werte nach
chirurgischer Tumorentfernung und ein Enzymanstieg bei Metastasierungsprechen für eine
Enzymproduktion durch neoplastische Osteoblasten (EHRHART et al. 1998).
Da die Messung der Gesamt-ALKP als Summe aller ihrer Isoenzyme zu verstehen ist,
könnenerhöhte Werte auch durch nicht tumorassoziierte Phänomene bedingt sein. Die wichtigsten
Fraktionen der Gesamt-ALKP (TALP) sind vor allem die knochenassoziierte ALKP (BALP), die leberassoziierte ALKP (LALP) und die kortikosteroidinduzierte ALKP (CALP). Bei vielen Kleintierpatienten
kommt es durch die Gabe kortikosteroidhaltiger Medikamente zur Erhöhung des steroidinduzierten Isoenzyms und damit der Gesamt-ALKP. Um diese Faktoren auszuschließen und die vorallem im Zusammenhang mit Knochentumoren relevante Fraktion des knochenassoziiertenIsoenzyms isoliert zu betrachten, wurde in einigen Untersuchungen die TALP in ihre verschiedenenIsoenzyme aufgetrennt und einzeln erfasst.
GARZOTTO und Mitarbeiter (2000) berichteten in diesem Zusammenhang, dass bei
Osteosarkompatienten ein statistisch relevanter Zusammenhang zwischen einer Erhöhung der TALP- und BALPAktivität vor der Behandlung und der Überlebenszeit besteht. Hunde mit einer TALP
beziehungsweise BALP im Referenzbereich hatten eine mediane Überlebenszeit von 12,5 beziehungsweise16,6 Monaten. Bei Erhöhung der TALP oder BALP wurde eine mediane Überlebenszeit von 5,5beziehungsweise 9,5 Monaten erreicht. Auch ERHART und Mitarbeiter (1998) beschrieben TALPund BALP als wichtige prognostische Faktoren. Erhöhte TALP- und BALP-Aktivitäten waren hierebenfalls mit kürzeren Überlebenszeiten verbunden.
Die Untersuchungen von KIRPENSTEIJN und Mitarbeitern (2002) zeigten auch kürzere krankheitsfreie
Intervalle und Überlebenszeiten bei Hunden mit erhöhter ALKP. Eine Serumenzymerhö-hung der ALKP
lag hier bei 30,6 % der ausgewerteten Patienten mit Osteosarkom vor. Bei dieserGruppe ließ sich
kein Vorteil durch den Einsatz einer adjuvanten Chemotherapie ermitteln. Diebeschriebenen
prognostischen Zusammenhänge beziehen sich alle auf eine Therapie durch Amputation beziehungsweise gliedmaßenerhaltender Chirurgie mit oder ohne Chemotherapie oder auf denalleinigen Einsatz von oralen Analgetika.
In der Literatur zur palliativen Bestrahlung bei caninen Osteosarkomen erwähnen lediglichMCENTEE und Mitarbeiter (1993), dass fünf der 15 Hunde (33,3 %) eine Erhöhung der ALKPhatten. Diese Tatsache wurde jedoch nicht hinsichtlich ihrer prognostischen Relevanz untersucht.Somit liegen Untersuchungen zum Zusammenhang zwischen einer ALKP-Erhöhung und demErfolg einer palliativen Bestrahlung nicht vor. WALTER und Mitarbeiter (2005) bestrahlten 14Hunde, die an einem appendikularen oder axialen Osteosarkom erkrankt waren, mit kurativerIntention (48-59,4 Gy Gesamtdosis). Es konnte bei dieser Untersuchung keine statistisch signifikante Korrelation zwischen der ALKP vor Behandlung und der Dauer der Tumorkontrolle festgestelltwerden.
Aus dem vorliegenden Patientengut erfuhren Hunde (n=18) mit einer Erhöhung der ALKP eineVerbesserung der Lahmheits- beziehungsweise Schmerzsituation um durchschnittlich 111 undmedian 77 Tage. Bei Patienten (n=12) mit einer ALKP im Referenzbereich lagen diese Werte beidurchschnittlich 144 und median 98 Tagen. Diese Unterschiede waren statistisch nicht signifikant(p=0,285).
5.2 Bestrahlungsresultate
5.2.1 Zeitraum bis zum Wirkungseintritt
Die Dauer
bis zum Wirkungseintritt war in beiden Gruppen variabel, insgesamt reichte das Spektrum von 1-25 Tagen (1-20/2-25). Die durchschnittliche Dauer lag bei sieben Tagen (9/6), mediandauerte es bis zum Wirkungseintritt sechs Tage (8/5). Diese Variabilität wird dadurch erklärt,
dassdie Wirkung einer palliativen Bestrahlung in eine sofort einsetzende und eine später
wirkendeKomponente unterteilt werden kann. Zum schnellen Wirkungseintritt führen zytotoxische
Prozessein den normalen Knochenzellen, die als Reaktion auf die Tumorzellen chemische Mediatoren
(zumBeispiel Prostaglandine, vor allem PGE2)
freisetzen (MCENTEE et al. 1993). Diese Mediatorenwiederum stimulieren die Nozizeptoren im
Periost, wodurch es zur Schmerzwahrnehmung kommt.Werden durch den Zelltod weniger solcher
Substanzen freigesetzt, reduziert sich beim Patienten dieSchmerzempfindung. Zudem werden
Begleitentzündungen zum Abklingen gebracht. Die späterwirkende Komponente manifestiert sich erst
nach über zwei Wochen und ist durch eine Rekalzifizierung und Reparatur von osteolytischen Läsionen bedingt (HOSKIN 1988, POULSEN et al.1989). In den publizierten Studien zur palliativen Bestrahlung von Osteosarkomen werden bezüglich der Dauer
bis zum Wirkungseintritt vergleichbare Ergebnisse beschrieben.

Vergleich der Studien zur palliativen Bestrahlung von caninen Osteosarkomen
hinsichtlich des Zeitraumes, medianer oder durchschnittlicher Dauer bis zum
Wirkungseintritt
Bei der vorliegenden Studie kam es mit median sechs Tagen schneller zum Wirkungseintritt. Die inTabelle 5 aufgeführten Studien benutzten Protokolle mit mindestens einer Woche Abstand zwischen den Fraktionen. Es ist auffällig, dass bei Patienten der Gruppe 2 die Wirkung durchschnittlichund auch median schneller einsetzte. Diese Tendenz erwies sich statistisch als nicht signifikant(p=0,458).
5.2.2 Grad der Wirkung
Die
Wirkung der palliativen Bestrahlung wurde durch eine Verbesserung des initial festgestelltenLahmheitsgrades oder eine bessere Lebensqualität durch Schmerzreduktion definiert. Bei diesemParameter wurde unabhängig vom Zeitpunkt die Maximalwirkung zur Auswertung herangezogen.Bei 27 Patienten (13/14) wurde eine Verbesserung des Lahmheitsgrades erreicht (90 %). ZweiPatienten (2/-) zeigten eine Verbesserung der Lebensqualität durch Verminderung des Schmerzes(6,7 %). Vier Hunde (2/2) waren nach der Bestrahlung vollkommen lahmheitsfrei, das heißt es kambei 13,3 % zur kompletten Remission von Lahmheit und Schmerz und bei 83,4 % zur partiellenRemission von Lahmheit und/oder Schmerz. Ein Patient (-/1) erfuhr keine Wirkung durch dieBestrahlungstherapie (3,3 %). Demnach war bei insgesamt 96,7 % der Patienten eine Wirkung inForm von Verbesserung der Lahmheit und/oder des Schmerzzustandes zu beobachten.
Der Lahmheitsgrad konnte bei den 27 Patienten um durchschnittlich 1,4 Grad (1,4/1,4) verbessertwerden. Ein Unterschied hinsichtlich des Ausmaßes der Wirkung in den beiden Versuchsgruppenkonnte nicht festgestellt werden. GREEN und Mitarbeiter (2002), MCENTEE und Mitarbeiter(1993) und RAMIREZ und Mitarbeiter (1999) machten keine Angaben über den Grad der Funktionsverbesserung der Gliedmaße beziehungsweise zum Ausmaß der Schmerzremission durch dieBestrahlung. Bei KLEITER und Mitarbeitern (2002) liefen fünf der sechs Hunde um etwa einenLahmheitsgrad besser. Bei keinem kam es jedoch zur völligen Lahmheitsfreiheit, so dass hier voneiner partiellen Remission bei 83 % der Patienten ausgegangen werden kann. BATEMAN undMitarbeiter (1994) beschreiben 74 % CR und 13 % PR, wobei hier aber bedacht werden muss, dassnicht ausschließlich Osteosarkome sondern verschiedene Tumoren palliativ bestrahlt wurden. Dievorliegende Studie stellt damit eine der ersten Untersuchungen dar, in der die Verbesserung derGliedmaßenfunktion systematisch nach Lahmheitsgraden untersucht wird.
5.2.3
Wirkungsdauer
Bei den
29 Patienten, die eine Bestrahlungswirkung zeigten, hielt diese 7-352 Tage an. Bei Gruppe1 lagen
Minimum und Maximum bei sieben beziehungsweise 236 Tagen, bei Gruppe 2 bei 36beziehungsweise 352
Tagen. Durchschnittlich bestand die Schmerzlinderung für 120 Tage(118/122), median für 99 Tage
(100/63). In diese Durchschnitts- und Medianwerte ist der Patientaus Gruppe 2, bei dem keine
Wirkung eintrat, mit null Tagen einbezogen. Der ermittelte Durchschnittswert lag bei Gruppe 2 um vier Tage höher, der Medianwert jedoch um 37 Tage niedriger.Die Gesamtwirkungsdauer (also inklusive dem Ergebnis der Wiederholungsbehandlungen) reichtevon 7-352 Tagen (7-346/36-352). Der Durchschnitt lag bei 124 Tagen (127/122), der Medianwertveränderte sich nicht und blieb bei 99 Tagen (100/63). Durch die Wirkung der wiederholtenBestrahlung erhöhte sich der Durchschnittswert für Gruppe 1 um neun Tage und lag damit fünfTage über der durchschnittlichen Wirkungsdauer von Gruppe 2. Die Wahl des Protokolls war fürdie Dauer der Schmerzlinderung statistisch nicht signifikant (p=0,902).
Die Ergebnisse von BATEMAN und Mitarbeitern (1994) lassen sich im Rahmen der
Betrachtungvon Wirkungsdauer und Überlebenszeit aufgrund der vielen unterschiedlichen, nicht
getrenntausgewerteten Tumortypen nicht zum Vergleich heranziehen. Bei GREEN und Mitarbeitern
(2002)reichte die Wirkungsdauer von 21 bis 536 Tagen mit einer durchschnittlichen respektive
medianenDauer von 163,2 beziehungsweise 94,5 Tagen. Dabei wurde nicht explizit erwähnt, ob die
Hundeohne Wirkung mit null Tagen inkludiert wurden. Zu Wiederholungsbehandlungen kam es bei
zweiHunden. Davon hatte nur einer ein appendikulares Osteosarkom. Die zusätzliche Zeit wurde
nichtmit in die Analyse für die Wirkungsdauer einbezogen.
RAMIREZ und Mitarbeiter (1999) geben eine Wirkungsdauer von 0-580 Tagen an, die
medianeWirkung lag bei 73 Tagen. Neun Hunde aus der Gruppe mit zwei Fraktionen zu je 8 Gy
erfuhreneine Wiederholungsbehandlung mit 8 Gy. Inwieweit und wie lange dies eine Wirkung zeigte
und obeine solche Wirkung in die Berechnung der medianen Wirkung mit einfloss, wird nicht
angegeben.Bei MCENTEE und Mitarbeitern (1993) reichte die Wirkung von 17-288 Tagen mit
medianerrespektive durchschnittlicher Wirkungsdauer von 130 beziehungsweise 116 Tagen. Ein Hund
wurdean Tag 291 wiederholt mit einer Fraktion zu 10 Gy bestrahlt. Ob dies eine Wirkung zeigte,
wirdnicht explizit erwähnt. Der Hund lebte jedoch insgesamt 468 Tage, weshalb eine erneute
Schmerzlinderung zu vermuten ist.
KLEITER und Mitarbeiter (2002) geben variable Wirkungszeiten von 15-280 Tagen an mit
einemDurchschnitt von 204 Tagen. Keiner der Patienten wurde erneut bestrahlt. Der Medianwert
derWirkungsdauer in der Untersuchung von RAMIREZ und Mitarbeitern (1999) lag unter dem
deranderen Studien. Dies kann daran liegen, dass hier der angegebene Bereich der Wirkungsdauer
mitnull beginnt und folglich Hunde ohne Wirkung mit null Tagen in die Berechnung
einbezogenwurden. In den anderen Studien wurde die mediane und durchschnittliche Wirkungsdauer
nur aufPatienten bezogen, bei denen ein Ansprechen auf die Therapie zu verzeichnen
war.
Da beide Berechnungsansätze grundsätzlich
möglich sind, wurde für die eigene Untersuchungentschieden, Patienten ohne Ansprechen auf die
Therapie mit null Tagen in die Berechnung zuinkludieren. Auf diese Weise werden die Daten bei
schlechten Ansprechquoten, aber guter Wirkungsdauer der Patienten mit Therapieerfolg nicht verfälscht.
RAMIREZ und Mitarbeiter (1999) hatten mit 95 Hunden mit appendikularem Osteosarkom
imVergleich zu 15 von 24 Gesamtstudienteilnehmern bei GREEN und Mitarbeitern (2002), 15
beiMCENTEE und Mitarbeitern (1993) und sechs bei KLEITER und Mitarbeitern (2002) die
weitausgrößte Anzahl an Patienten, so dass die ermittelten Medianwerte präziser sind. Bei GREEN
undMitarbeitern (2002) könnte zusätzlich auch die Wahl des Bestrahlungsprotokolls den
Therapieerfolgbeeinflusst haben. Sie applizierten an den Tagen 0, 7, 14 und 21 jeweils 8 Gy,
womit von Anfang anhöhere Gesamtdosen erreicht und die zweiwöchige Pause zwischen der zweiten
und drittenBestrahlung in konventionellen 0-7-21-Protokollen eliminiert wurde. Es kann
postuliert werden,dass in einer solchen Pause sowohl der Tumor als auch die
Prostaglandin-produzierenden Knochenzellen mehr Möglichkeit zur Reparation und Repopulation haben.
Bezogen auf die Spannweite der Wirkungsdauer sind die vorliegenden Ergebnisse vergleichbar
mitdenen der Literatur. Auch die medianen und durchschnittlichen Werte ähneln denen von
GREENund Mitarbeitern (2002) und RAMIREZ und Mitarbeitern (1999).
Der mediane Wert von MCENTEE und Mitarbeitern (1993) und der Durchschnittswert vonKLEITER und Mitarbeitern (2002) liegen deutlich über den in der vorliegenden Studie ermittelten.Hier gilt es jedoch zu bedenken, dass bei diesen die Patientengruppe wesentlich kleiner war undHunde ohne Wirkung nicht mit einbezogen wurden.
5.2.4 Wiederholung von Fraktionen
Nur bei
wenigen Patienten aus den zitierten Publikationen wurden Wiederholungsbestrahlungendurchgeführt.
Zudem erfolgte keine gezielte Auswertung der erneuten Ansprechquote und -dauer.Bei drei
Patienten (10 %, alle aus Gruppe 1), wurde eine Wiederholungsbestrahlung mit einereinzelnen
Fraktion zu 9 Gy durchgeführt. Bei einem der Hunde zeigte diese Bestrahlung keineWirkung mehr,
bei den anderen beiden verbesserten sich Lahmheit und Schmerzhaftigkeit erneutdeutlich. Die
zweite Phase der Schmerzlinderung hielt bei einem Patienten für weitere 110 Tage,bei dem anderen
Patienten für 23 Tage an, so dass bei diesen Patienten eine Gesamtwirkungsdauervon 378
beziehungsweise 203 Tagen erzielt wurde. In dieser kleinen Gruppe mit wiederholterStrahlentherapie hatten die Hunde eine durchschnittliche und mediane Wirkungszeit von 203beziehungsweise 199 Tagen. Wurde nicht wiederholt bestrahlt (n=27), so lag die durchschnittlicheund mediane Wirkungsdauer mit 116 und 98 Tagen niedriger. Da die Gruppen jedoch sehr ungleichgroß sind und nur sehr wenige Patienten wiederholt bestrahlt wurden, sind diese Werte nichtstatistisch auswertbar.
Die Patienten, bei denen es durch die Wiederholungsbestrahlung zur erneuten
Schmerzlinderungkam, hatten auf die Erstbestrahlung deutlich länger angesprochen als der
Patient, bei dem dieZusatzbestrahlung keine Wirkung mehr zeigte. Zwar sind die Patientenzahlen
für eine statistischeAuswertung der prognostischen Faktoren von Wiederholungsbestrahlungen zu
gering, doch scheintsich zumindest ein Trend für bessere Ergebnisse bei Patienten abzuleiten,
bei denen im Rahmen derErstbestrahlung eine längere Wirkungsdauer erzielt wurde. Der Vergleich
von Gruppe 1 und 2 imHinblick auf strahlenbiologische Aspekte wird nachfolgend unter Kapitel
5.2.6 abgehandelt.
5.2.5 Überlebenszeit oder Studiendauer, Gründe für Tod beziehungsweise Studienabbruch
Die Überlebenszeit beziehungsweise die Zeitspanne bis zum Abbruch der Studie durch Amputationder Gliedmaße lag bei 20 bis 378 Tagen (21-378/20-366). Im Durchschnitt betrug dieser Zeitraumfür beide Gruppen zusammen 145 Tage (150/139), der Medianwert lag bei 137 Tagen (137/105).Sowohl die durchschnittliche als auch die mediane Überlebenszeit von Gruppe 1 liegt über denerreichten Werten von Gruppe 2. Diese Tendenz für längere Überlebenszeiten in Gruppe 1 warstatistisch nicht signifikant (p=0,738).
Die Überlebenszeiten bei Patienten mit appendikularen Osteosarkomen in der Studie von
GREENund Mitarbeitern (2002) schwankten zwischen 35 und 550 Tagen. Durchschnittlich
respektivemedian lagen sie bei 313 beziehungsweise 243,8 Tagen, wobei auch hier als Endpunkte
Tod,Euthanasie oder Amputation gerechnet wurden. Die Überlebenszeiten lagen also
durchschnittlich80,6 und median sogar 218,5 Tage über den angegeben Wirkungszeiten. Diese
Ergebnisse sinderstaunlich, da selbst beim Einsatz starker oraler Analgetika bei einem
Wiederauftreten vonLahmheit und Schmerz kaum solche Zeiten zu erwarten sind. Dieser Sachverhalt
wird jedoch vonGREEN und Mitarbeitern (2002) nicht weiter diskutiert.
Bei RAMIREZ und Mitarbeitern (1999) lagen die Überlebenszeiten zwischen sieben und
2035Tagen. Der mediane Wert betrug 122 Tage. Die Tatsache, dass in dieser Publikation eine
Amputation nicht zum Abbruch der Studie führte, sondern die Überlebenszeiten weiter gezählt wurden,erklärt die im Vergleich zu anderen Studien höheren Überlebenszeiten. Gleiche Berechnungsgrundlagen wurden
auch in der Studie von MCENTEE und Mitarbeitern (1993) zu Grunde gelegt. DiePatienten lebten
zwischen 29 und 468 Tage mit medianen und durchschnittlichen Überlebenszeitenvon 125 und 159
Tagen.
Bei KLEITER und Mitarbeitern (2002) bewegte sich die Überlebenszeit zwischen 120 und
371Tagen und wurde mit durchschnittlich 231,8 Tagen angegeben. Dieser Wert ist im Vergleich
zurvorliegenden Studie und den Untersuchungen von MCENTEE und Mitarbeitern (1993)
undRAMIREZ und Mitarbeitern (1999) recht hoch, obwohl ein ähnliches
Bestrahlungsprotokollverwendet wurde. Die geringe Anzahl an Studienteilnehmern (n=6) könnte hier
jedoch bereitszufällig zu überproportional guten Werten führen.
Die Ergebnisse der vorliegenden Studie sind vergleichbar mit denen von MCENTEE und Mitarbeitern
(1993) und RAMIREZ und Mitarbeitern (1999). Es gibt keine gute Erklärung dafür, dass dievorliegende mediane und durchschnittliche Überlebenszeit deutlich unter der von GREEN undMitarbeitern (2002) liegt, zumal die mediane Dauer der Wirkung vergleichbar ist. Als Erklärung
fürdie Ergebnisse von GREEN und Mitarbeitern (2002) könnte eine höhere Toleranz der
Besitzergegenüber der Lahmheit und Schmerzhaftigkeit ihrer Hunde angeführt werden.
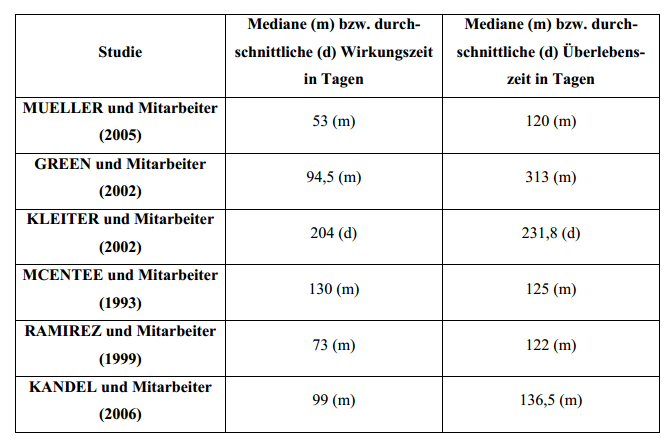
Vergleich der medianen beziehungsweise durchschnittlichen Wirkungs- und
Überlebenszeiten
In dem vorliegenden Patientengut wurden 19 (11/8) Patienten wegen Progression der
Lahmheiteuthanasiert. Eine Gliedmaßenamputation wurde bei drei (1/2) Patienten wegen
progressiverLahmheit und bei einem (-/1) Patienten wegen pathologischer Fraktur durchgeführt.
Ein (-/1)Patient starb mit plötzlichem Auftreten von Epistaxis. Als Ursache hierfür wurde die
seit Therapiebeginn bestehende Metastasierung in die Lunge vermutet. Ein Patient (-/1) verstarb an einerPneumonie. Ein Hund (1/-) wurde wegen schlechtem Allgemeinzustand bei guter Gliedmaßenbelastung
euthanasiert. Zwei Studienteilnehmer (2/-) wurden wegen einer pathologischen Fraktur derbetroffenen Gliedmaße euthanasiert. Zwei (-/2) Patienten sind bei guter Gliedmaßenbelastung zumZeitpunkt des Abschlusses der Studie am 31.12.04 noch am Leben.
GREEN und Mitarbeiter (2002) gaben eine tumorassoziierte Todesursache bei 18 von 24
Hundenan. Der Grund für die Euthanasie war bei zehn Patienten die Progression der lokalen
Erkrankung,bei acht Patienten eine Metastasenbildung. Ein Hund war zum Studienende noch am
Leben, undfünf starben aus anderen Gründen. In der Untersuchung von RAMIREZ und Mitarbeitern
(1999)starben 57 von 95 Hunden aus tumorassoziierten Gründen, bei 29 war die Todesursache
unbekannt,ein Patient erlag den Folgen einer Magendrehung und zehn waren bei Auswertung noch am
Leben.(Die Addition der angegebenen Patientenzahlen dieser Studie ergibt allerdings 97
Patienten, was imWiderspruch zur initial angegebenen Patientenzahl steht.)
Bei MCENTEE und Mitarbeitern (1993) wurden 11 von 15 Hunden wegen primärem und
sekundä-rem Osteosarkom euthanasiert, vier wurden Gliedmaßen amputiert und einer starb an einer
anderenErkrankung. Bei KLEITER und Mitarbeitern (2002) wurde ein Hund auf Besitzerwunsch
ohneKrankheitsprogression und fünf Patienten tumorassoziiert euthanasiert. Die Gründe für das
Ablebensind demnach mit denen aus den Literaturangaben vergleichbar.
5.2.6 Vor- und Nachteile der beiden Therapieprotokolle
Ziel einer palliativen Therapie muss die Verbesserung der Lebensqualität in Form einer Schmerzlinderung oder Funktionsverbesserung ohne starke Belastung des Patienten durch die Therapiebeziehungsweise ihre Nebenwirkungen sein (SIEGEL und CRONIN 1997). Diese Forderung wurdebei beiden Protokollen dieser Arbeit ausreichend erfüllt. Drei Patienten aus Gruppe 2 zeigten nachden ersten Bestrahlungen für einige Tage eine etwas stärkere Lahmheit. Diese kurzfristige Verschlechterung könnte in der lokalen Veränderung des Säure-Basen-Milieus (Azidose zu Alkalose)und Beschleunigung sowie dadurch kurzfristigen Verstärkung der begleitenden Entzündungbegründet sein (TROTT et al. 1994).
Ansonsten
waren bei beiden Gruppen keine signifikanten Nebenwirkungen fest zu stellen. AlsBestrahlungsnebenwirkung kam es im Bestrahlungsfeld lediglich zu einem langsameren Nachwachsen des
geschorenen Fells und zum Teil zu leichten Pigmentveränderungen von Haut und Fell, wasjedoch zu
keiner Beeinträchtigung der Hunde führte. Auch der Behandlungsaufwand stand in denallermeisten
Fällen in einem angemessenen Verhältnis zum Nutzen für das Tier. Das Narkoseprotokoll erwies sich als ausgesprochen gut verträglich. Die Patienten konnten im Anschluss an dieBehandlung innerhalb von maximal 45 Minuten die Klinik wieder verlassen.
Beurteilt man die beiden Protokolle im Hinblick auf den Aufwand für das Tier, so ist natürlich diedreimalige gegenüber der fünfmaligen Behandlung vorzuziehen. Neben der Vermeidung von zweiAnästhesien ist auch der Abstand zwischen den Behandlungen prinzipiell günstiger für die Patienten. Allerdings kam es selbst bei den zum Teil geriatrischen Patienten nicht zu Problemen durchfünf Behandlungen in Folge. Ökonomisch gesehen ist das Protokoll der Gruppe 1 (3x9 Gy) zubevorzugen, da die Kosten für zwei weitere Behandlungen entfallen. Im Hinblick auf logistischeÜberlegungen gab es individuell unterschiedliche Vorteile beider Protokolle. Manche Besitzerempfanden eine dreimalige Anreise (Gruppe 1) als vorteilhaft. Von anderen wiederum wurde esbesonders bei sehr weiten Anreisedistanzen als günstiger beurteilt, wenn die Behandlung innerhalbvon einer Woche abgeschlossen werden konnte (Gruppe 2).
Strahlenbiologisch ist die häufigere Applikation kleinerer Einzeldosen günstiger, da hohe Einzeldosen das spätreagierende Gewebe, das keine große Regenerationskapazität besitzt, stärker und meistirreversibel schädigen. Bei Bestrahlungen im Gliedmaßenbereich stellen Knochen, Muskeln,Nerven und Sehnen die spätreagierenden Gewebe dar. Betrachtet man die Wahrscheinlichkeit fürSpätschäden jedoch rein pragmatisch, so muss bedacht werden, dass die zu erwartende Wirkungsdauer und damit meist auch Überlebenszeit der bestrahlten Patienten bei circa drei bis siebenMonaten liegt. Nebenwirkungen an spätreagierenden Geweben treten aber in der Regel erst nachmehreren Monaten bis Jahren ein, so dass alleine schon aufgrund dieser Tatsache kaum Konsequenzen zu erwarten sind. Die Gesamtdosis von 27 Gy in Gruppe 1 ist nicht als kritische Dosis zu sehen.Bedeutung erlangt diese Überlegung erst, wenn es um die Wiederholung von Fraktionen geht. DieErfahrungen dieser Studie haben jedoch gezeigt, dass nur bei wenigen Patienten (hier 3 von 30) einezusätzliche Bestrahlung durchgeführt wurde. Diese drei Patienten gehörten zur Gruppe 1. DieBesitzer der Hunde aus Gruppe 2 wünschten bei Wiederauftreten von Lahmheiten keinen erneutenBehandlungszyklus. Diese Diskrepanz zwischen Gruppe 1 und 2 kann zufällig sein, könnte aberauch an dem Mehraufwand durch stärkere Fraktionierung und der täglichen Applikation beiProtokoll 2 liegen.
Diese
Erfahrungen hinsichtlich der Wiederholung von Bestrahlungen decken sich mit den an derNorth
Carolina State University gemachten Beobachtungen (persönliche Auskunft Miriam Kleiter).An
dieser Institution wird ebenfalls mit 5x4 Gy bestrahlt. Die Möglichkeit der erneuten Therapiewird kaum genutzt, so dass sich der Vorteil der risikoärmeren Wiederholungsbestrahlung bei5x4 Gy entscheidend relativiert. Auch in einer humanmedzinischen Studie von STEENLAND undMitarbeitern (1999), in der Patienten mit 1x8 Gy (Gruppe 1) oder 6x4 Gy (Gruppe 2) zur
Palliationvon Knochenmetastasen verglichen wurden, erfuhren aus Gruppe 1 mit 25 % deutlich
mehrPatienten eine Wiederholungsbestrahlung als Patienten aus Gruppe 2 (7 %).
Ein Vergleich der Ergebnisse zu den Erfahrungen beim Menschen ist nicht direkt möglich, da hierpalliative Bestrahlungen fast ausschließlich zur Therapie von Metastasen anderer Primärtumoren,vor allem Karzinome von Brust, Prostata, Lunge und Nieren, eingesetzt werden. Menschen mitOsteosarkomen im appendikularen Skelett werden fast ausnahmslos mit einer Amputation odergliedmaßenerhaltenden Operationstechnik und adjuvanter Chemotherapie versorgt. Da Osteosarkome beim Menschen vorwiegend bei juvenilen Patienten vorkommen, werden hier palliativeMaßnahmen wie die Bestrahlung zur Schmerzlinderung kaum in Betracht gezogen.
Die
beiden Protokolle wurden hinsichtlich Wirkungseintritt, Wirkungsgrad, Wirkungsdauer undÜberlebenszeit miteinander verglichen. Eine Wirkung im Sinne einer Verbesserung der Lahmheitund/oder Schmerzhaftigkeit trat bei allen Patienten aus Gruppe 1 ein, in Gruppe 2 bei 14 von 15Patienten (93,3 %). Der Zeitraum, in dem es ab Bestrahlungsbeginn zum Eintritt der Wirkung kam,war bei Gruppe 2 sowohl durchschnittlich als auch median um drei Tage kürzer als bei Gruppe 1.Im T-Test war dies statistisch nicht signifikant. Das Ausmaß der Wirkung, das als eine Verbesserung in
Lahmheitsgraden gemessen wurde, war bei beiden Gruppen gleich. Die Dauer der Wirkungohne
Wiederholungsbestrahlungen war bei Gruppe 1 durchschnittlich um 4 Tage geringer, medianjedoch um
37 Tage länger. Rechnet man die Wiederholungsbestrahlung mit ein, so bleibt erwartungsgemäß der Medianwert gleich. Der Durchschnittswert von Gruppe 1 liegt hiermit um 5 Tagehöher als der von Gruppe 2. Die Überlebenszeiten in Gruppe 1 lagen durchschnittlich um 12 Tage,median sogar um 22 Tage höher als bei Gruppe 2. Diese Unterschiede in der Wirkungsdauer warenstatistisch nicht signifikant.
Diese Untersuchungen lassen den Schluss zu, dass beide Bestrahlungsprotokolle wirksam,
ohnesignifikante Nebenwirkungen und mit vergleichbarem Erfolg zur palliativen Therapie von
caninenappendikularen Osteosarkomen geeignet sind. Patienten aus Gruppe 2 hatten einen etwas
schnelleren Wirkungseintritt, der jedoch statistisch nicht signifikant war (p=0,753). Aufgrund des geringeren Aufwandes für Besitzer und Tier kann bei statistisch gleichen Ergebnissen zu
Protokoll 1geraten werden. Da statistisch kein Unterschied zwischen Gruppe 1 und 2 nachzuweisen
war,können logistische Gründe durchaus als Entscheidungsgrundlage akzeptiert werden. Die
2-wöchigePause zwischen der zweiten und dritten Bestrahlung in Protokoll 1 könnte jedoch
zukünftig auf eineWoche verkürzt werden, da strahlenbiologisch keine Notwendigkeit hierfür
besteht und eventuellsogar Nachteile durch stärkere Repopulation des Tumors entstehen.
6 Zusammenfassung
Bettina Kandel-Tschiederer (geb. Kandel)
Palliative Bestrahlung mit 60Co-Teletherapie beim appendikularen Osteosarkom des Hundes
Klinik für KleintiereVeterinärmedizinische Fakultät, Universität Leipzig
Eingereicht im Februar 2008
86 Seiten, 13 Abbildungen, 6 Tabellen, 301 Literaturangaben, Anhang 1 (7 Tabellen), 2 und 3
Schlüsselwörter: Osteosarkom - Hund - Bestrahlungstherapie - palliativ
Osteosarkome sind die häufigsten primären caninen Knochentumoren im appendikularen Skelett.Die Therapiemöglichkeiten mit kurativer Intention sind eine Kombination von Amputation odergliedmaßenerhaltender Tumorentfernung mit adjuvanter Chemotherapie. Ein beträchtlicher Anteilan Besitzern lehnt solche Maßnahmen ab, und einige Patienten eignen sich wegen anderweitigengesundheitlichen Problemen oder Tumoren in ungünstigen Lokalisationen nicht für diese Therapieformen. Durch palliative Strahlentherapie ist es möglich, tumorassoziierten Knochenschmerz zulindern. Sie dient deshalb als Alternative zu den oben genannten Optionen.
Ziel
dieser Studie war es, den Effekt einer fraktionierten palliativen 60Cobalt-Bestrahlung beiHunden mit appendikularen Osteosarkomen zu dokumentieren. Weiterhin wurde evaluiert, ob einZusammenhang zwischen dem lokalen Tumorstadium und der Dauer der Schmerzlinderungbeziehungsweise Lahmheitsverbesserung bestand. Zwei verschiedene palliative Bestrahlungsprotokolle wurden
hinsichtlich des Grades, dem Zeitpunkt des Eintretens und der Dauer der Wirkung,Nebenwirkungen
und der Möglichkeit zur Wiederholung der Bestrahlung bei Wiederauftreten derSymptome verglichen.
Eine weitere Aufgabenstellung war das Etablieren von prognostischenParametern für die palliative
Bestrahlung.
30 Hunde mit tumorösen Veränderungen in den langen Röhrenknochen, die typische röntgenologische
Veränderungen und Lahmheit zeigten, wurden randomisiert in zwei Gruppen eingeteilt.Gruppe 1
bekam drei Fraktionen zu 9 Gy an Tag 0, 7 und 21. Gruppe 2 erhielt fünf Fraktionen zu4 Gy an
Folgetagen. Wiederholungsbestrahlungen wären bei beiden Gruppen möglich gewesen,wurden aber nur
von drei Patienten aus Gruppe 1 in Anspruch genommen. Diagnose und klinischeStadieneinteilung
basierten auf klinischer Untersuchung, Blutbild, Blutserumuntersuchungen,Lahmheitsgrad (Grad
0-IV), Grad der Muskelatrophie der betroffenen Gliedmaße, Röntgenbilderndes Primärtumors in zwei
Ebenen, CT-Analyse des Primärtumors, Metastasensuche in der Lungeper Thoraxröntgen und CT, ante
oder post mortem histologischer Untersuchung des Tumors oderFeinnadelaspiration (letztere wenn
möglich).
Die Tumorlokalisation war variabel, die häufigsten Stellen waren proximal im Humerus
(n=13),distal in der Tibia (n=5) und distal im Radius (n=4). 11 Patienten hatten eine Anämie und
19 Hundeeinen Anstieg der Alkalischen Phosphatase im Serum. Der Lahmheitsgrad reichte von I-IV
miteinem Medianwert von 2,75. Bei 19 Hunden lag eine Muskelatrophie der betroffenen
Gliedmaßevor. Die vom Tumor involvierte Knochenlänge schwankte zwischen 16,3 und 83,3 % mit
einemMedianwert von 41 %. Die Tumorlänge wurde bei 21 Patienten in der CT länger eingeschätzt
alsauf den Röntgenaufnahmen. Der Tumorlyseindex lag zwischen I und V (median III). Zu
Behandlungsbeginn hatten sechs Patienten sichtbare Lungenmetastasen auf den Röntgenbildern und in derCT. Aufgrund der Röntgenbilder wäre kein Patient mit makroskopischen Metastasen übersehenworden, jedoch konnten in der CT mehr Veränderungen diagnostiziert werden.
Das Einsetzen der Wirkung schwankte zwischen 1 und 25 Tagen nach Bestrahlungsbeginn.
EinPatient erfuhr keine Linderung, vier Hunde liefen vollkommen lahmheitsfrei und die
verbleibenden25 Patienten hatten eine signifikante Verbesserung der Schmerz- beziehungsweise
Lahmheitssituation. Die Wirkungsdauer inklusive der Wiederholungsbestrahlungen betrug 0-352 Tage (durchschnittlich 124 und median 99 Tage). Keines der Protokolle führte zu signifikanten
Nebenwirkungen. Insgesamt konnte bei 96,7 % der Patienten eine partielle oder komplette Schmerzlinderungerreicht werden. Vergleiche zwischen Gruppe 1 und 2 bezüglich des Grades der Wirkung ergabenkeinen Unterschied. Die Wirkung trat bei Protokoll 2 etwas schneller ein, dafür war die medianeWirkungsdauer bei Protokoll 1 um 37 Tage länger. Diese Unterschiede waren statistisch nichtsignifikant.
Bezüglich der möglichen prognostischen Parameter hatten Hunde mit weniger als 41 %
Knochenbeteiligung eine längere Wirkungsdauer. Bei geringerem Lahmheitsgrad vor Therapie dauerte dieWirkung etwas länger an. Patienten mit langer Dauer der Lahmheit vor Bestrahlung hatten einelängere Wirkungsdauer. Alle anderen möglichen prognostischen Parameter erwiesen sich alsstatistisch nicht signifikant.
7 Summary
Bettina Kandel-Tschiederer (nee Kandel)
Palliative 60Co-teletherapy for canine appendicular osteosarcomaDepartment of Small Animal
MedicineFaculty of Veterinary Medicine, University of Leipzig
Submitted in February 2008
86 pages, 13 figures, 6 tables, 301 references, appendices 1 (7 tables), 2 and 3
Keywords:
osteosarcoma - dog - radiotherapy - palliative
Osteosarcoma is the most common primary bone tumour of the canine appendicular
skeleton.Treatment options with curative intent are limb amputation or limb-sparing surgery
followed byadjuvant chemotherapy. However, a considerable proportion of animal owners will
reject thisoption and there are dogs with concurrent problems or tumours in the wrong
localisation whichpreclude them from being good candidates for limb amputation or limb-sparing
surgery. Palliativeradiotherapy is quite effectively capable of eliminating pain associated with
osseous tumors andtherefore can serve as an alternative to standard treatment.
Goal of this study was to document the effect
of fractionated palliative 60Cobalt radiotherapy indogs with appendicular osteosarcomas. Furthermore it was evaluated if there is a correlationbetween tumour stage and effect of treatment concerning duration of pain relief/reduction oflameness. Furthermore we compared two palliative radiation protocols concerning magnitude, onsetand duration of pain relief, side effects and possibility of repeating the radiotherapy upon reemergence of
pain and to establish prognostic parameters for outcome of palliative radiation.
30 dogs
with tumours involving the long bones (all localisations) with typical radiographic lesionsand
visible lameness were randomized into two groups, receiving three fractions of 9 Gy on days 0,7
and 21 (group 1), or five fractions of 4 Gy on consecutive days (group 2). For re-irradiationbecause of re-occurrence of pain symptoms, three patients in group 1 received one fraction of 9
Gy,patients in group 2 would have repeated a full course of 5x4 Gy, but none of the owners was
willingto repeat
radiotherapy.
Diagnosis and clinical staging were based on clinical examination, CBC, blood chemistry, degree
oflameness (grades 0-IV), degree of muscle atrophy compared to the opposite limb, radiographs of
thetumour in two views, CT analysis of the tumour, search for metastases by thoracic x-rays and
CTexamination of the thorax, ante or post mortem histological examination or fine needle
aspirationcytology (if possible).
Localisation of the tumours was variable, but most of them were located in the proximal
humerus(n=13), distal tibia (n=5) and distal radius (n=4). There were 11 patients with a
decrease of RBCand 19 patients with an elevation of the ALKP. The degree of lameness before
radiotherapy wasvery variable (from I to IV) with a median value of 2.75. In 19 patients we
found muscle atrophy ofthe affected limb. The bone length involvement measured from 16.3 up to
83.3 %, the median valuewas 41 %. In 21 patients tumour length in the CT was measured to be
longer than on x-rays. Theindex of tumour lysis ranged from I to V with a median value at grade
III. Six patients had visiblemetastases to the lungs on x-rays and CT. In this study no patient
would have been missed withmetastases on x-rays, but looking at the CT more metastases were
counted than on x-rays.
Overall there was a variable
onset of effect between 1 and 25 days after the beginning of radiation.One dog showed no effect,
four dogs were completely free of lameness and 25 patients experienceda significant improvement
of their pain and/or lameness situation. The duration of pain relief,including repeated
radiotherapy, ranged from 0–352 days, with a mean and median duration of124.4 and 99 days,
respectively. In both groups there were no significant side effects. In total therewas a partial
or complete pain reduction in 96.7 % of the patients. Comparison of groups 1 and 2revealed that
there was no statistically significant difference in the degree of effect. The onset ofeffect
occurred faster in group 2, but the pain reduction lasted longer in group 1 (median duration37
days longer than group 2). These differences were not statistically significant.
Looking at the possible prognostic factors, dogs with bone length involvement of less than 41
%had better duration of response. Dogs with a lower degree of lameness at the beginning of
treatmenthad longer durations of pain reduction. If the lameness existed for a longer time
before treatment,pain reduction lasted longer. There were no further statistically significant
parameters.














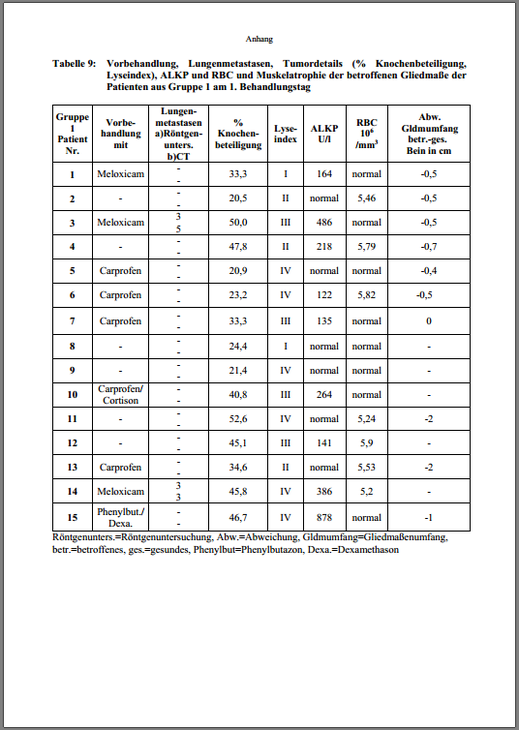






















Share this article / Teilen Sie diesen Artikel
Diese Webseite wurde mit Jimdo erstellt! Jetzt kostenlos registrieren auf https://de.jimdo.com