Article added / Artikel hinzugefügt 01.10.2021
Generally Articles and Discussions about Osteosarcoma in Dogs
→ Evaluations of phylogenetic proximity in a group of 67 dogs with
osteosarcoma: a pilot study
Article added / Artikel hinzugefügt 01.10.2021
Generally Articles and Discussions about Osteosarcoma in Dogs
→ Canine Periosteal Osteosarcoma
Images added / Abbildungen hinzugefügt 02.05.2019
Generally Sonography Atlas of Dogs →
Cardiovascular system → Pulmonary vessels
New subcategory added / Neue Unterkategorie hinzugefügt 02.05.2019
Generally Sonography Atlas of Dogs →
Cardiovascular system → Pulmonary vessels
Images added / Abbildungen hinzugefügt 01.05.2019
Generally Sonography Atlas of Dogs →
Cardiovascular system → Heart valvular diseases



Maulhöhlentumore bei Hund und Katze: Kann Bestrahlungstherapie die lokale Tumorkontrolle verbessern?

Franziska Schmid, "Maulhöhlentumore bei Hund und Katze: Kann Bestrahlungstherapie die lokale Tumorkontrolle verbessern?", Mai 2013

1.Einleitung und Fragestellung
Krebs ist eine sehr schwere, in malignen Fällen oft unheilbare Erkrankung und eine der häufigsten Todesursachen bei Hunden und Katzen. So sterben rund 50% der Hunde und 33% der Katzen an malignen
Tumorerkrankungen, wobei hier v.a. ältere Tiere betroffen sind (MORRIS u. DOBSON, 2001a; RUSK, 2005).
Heutzutage weisen die in Obhut des Menschen lebenden Hunde und Katzen eine immer höhere Lebenserwartung auf. Dies mag zum einem an dem medizinischen Fortschritt in der Veterinärmedizin in den
letzten 10 bis 20 Jahren liegen, aber zum anderen auch am zunehmenden Bewusstsein und den steigenden finanziellen Möglichkeiten der Tierbesitzer. Da Krebs generell eine Erkrankung älterer Tiere
darstellt, erhöht sich dadurch aber auch die Anzahl der an Krebs erkrankten Tiere (KESSLER, 1999a; WITHROW, 2007).
Bei der Behandlung von Tumoren ist ein gut geplantes Vorgehen notwendig, welches immer wieder eine Herausforderung für den Tierarzt darstellt. Je nach Tumorart,Lokalisation, Größe, biologischem Verhalten, etc. müssen sich z.B. Fragen gestellt werde wie: Welche Behandlungsmöglichkeiten verwenden wir? Behandeln wir den Patienten mit einer Monotherapie oder einer Kombinationstherapie aus Chirurgie, Bestrahlung u./o. Chemotherapie? Spricht dieser Tumor überhaupt auf eine Bestrahlung an? Wenn ja setzen wir sie präoperativ oder postoperativ ein (ESTRIN, 2009)?
Außerdem darf bei der Therapieplanung auch nicht die starke emotionale Belastung der Tierbesitzer außer Acht gelassen werden. Für viele ist das Haustier heutzutage ein gleichwertiges Familienmitglied geworden. Sie wollen nur das Beste für ihr Tier und fühlen sich verpflichtet, für sie bis an ihr Lebensende gut zu sorgen. Natürlich ist die Diagnose „Krebs“ oft sehr beunruhigend und viele Menschen verbinden Behandlungen, wie Strahlen o. Chemotherapie, mit akuten Nebenwirkungen wie: Übelkeit, Gewichtsverlust, Haarausfall oder Mattigkeit, die in der Humanmedizin durchaus sehr häufig auftreten, bei Tieren jedoch nicht in einem solch starken Ausmaß zu sehen sind (SIMON, 2000a). Einige Leute stehen der Möglichkeit, einen Tumor beim Tier zu behandeln, immer noch sehr kritisch gegenüber und fragen sich, warum man den Tieren diese teils sehr aufwendigen Therapien zumuten soll.
Viele chronische Krankheiten sind nicht heilbar (z.B. einige endokrinologische Erkrankungen und Herzprobleme)
und werden routinemäßig behandelt. Auch Krebs zählt zu den chronischen Krankheiten und kann davon abgesehen, in vielen Fällen benigner Tumore auch geheilt werden (VAIL, 2009; VILLALOBOS,
2008).
Aber auch bei malignen Tumoren, die trotz Therapie nicht geheilt werden können, ist in vielen Fällen eine Tumorkontrolle über eine bestimmte Zeitspanne bei guter Lebensqualität erreichbar. Auch wenn für manche Besitzer eine Verlängerung der Überlebenszeit um z.B. 1 Jahr nicht lange erscheint, ist die bezogen auf die durchschnittliche Lebenszeit von Hunden und Katzen doch ein ansehnlicher Zeitgewinn.
Dies verdeutlicht, dass bei der Tumorbehandlung eine weitere Aufgabe der Tierärzte darin besteht, individuell auf jeden Tierbesitzer einzugehen und sie über alle Behandlungsmöglichkeiten
aufzuklären (KESSLER, 1999a; NORTH u.
BANKS, 2009a).
Ziel meiner Diplomarbeit war es retrospektiv zu evaluieren, inwieweit eine
Bestrahlungstherapie einen therapeutischen Effekt auf die lokale Tumorprogression von malignen Maulhöhlen-tumoren bei Hunden und Katzen hat.
2. Literaturübersicht
2.1 Tumore der Maulhöhle - Grundlagen
2.1.1 Tumorentstehung
Tumore sind im Allgemeinen Gewebezubildungen. Auslösende Faktoren können sowohl exogener (chemische, physikalische und infektiöse Noxen) als auch endogener (Alter, Geschlecht, familiäre Disposition, individuelle genetische Veranlagung) Natur sein, die eine Tumorentwicklung durch eine Veränderung des genetischen Materials bewirken (MISDORP, 1999; NOLTE u. NOLTE, 2000a).
Eine wichtige Rolle spielen hierbei bestimmte Gene, sogenannte Proto-Onkogene, deren Hauptaufgabe die Regulation des
Zellwachstums, der Zellteilung und der Zelldifferenzierung ist. Nach Mutation entstehen aus ihnen
Onkogene, deren Produkte das Tumorwachstum fördern können, da sie zu einer abnormen Aktivierung des Zellwachstums führen. Typisch für Tumorzellen
sind ein unbegrenztes autonomes Wachstum, eine erhöhte Wachstumsgeschwindigkeit und
eine ungehemmte Proliferation (ARGYLE u. KHANNA, 2007; MISDORP, 1999; NOLTE u. NOLTE, 2000a).
Generell geht man aber davon aus, dass alle Tumore monoklonalen Ursprungs sind, das heißt aus einer einzigen entarteten Zelle hervorgehen. Jedoch müssen in der Regel mehrere Mutationen auftreten, die jede für sich die genetisch veränderte Zelle mit einem Selektionsvorteil gegenüber den normalen Nachbarzellen ausstattet, bevor sich aus der normalen Zelle, eine Tumorzelle und daraus ein invasiver, metastasierender Tumor entwickeln kann (MISDORP, 1999; NOLTE u. NOLTE, 2000a; MORRISON, 1998a).
Die Maulhöhle ist eine der häufigsten Primärlokalisationen für Tumore bei Hunden und Katzen, da die Oberfläche der Maulschleimhaut einer Vielzahl an krebserregenden Stoffen und Umweltweinflüssen ausgesetzt ist. So machen maligne orale Tumore beim Hund 6 % und bei der Katze 3 % aller Tumore aus (CRONIN, 2006a; KESSLER, 1999e; MORRIS u.DOBSON, 2001c).
2.1.2 Tumorklassifizierung
Bevor man sich als Tierarzt für eine Therapieform entscheidet und eine Prognose gegenüber den Besitzern ausspricht, muss man eine möglichst genaue
Kenntnis über die histologische Art und den Grad des Tumors haben, sowie über dessen Größe, anatomische Ausdehnung und Fähigkeit zur Bildung von
Metastasen (DOBSON, 1998a; MORRISON, 1998b; NOLTE u. NOLTE, 2000b).
Pierre Denoix hat in den Jahren 1943-1952 für die objektive Erfassung von Tumorerkrankungen das sogenannte "TNM-System“ eingeführt, mit dem die Weltgesundheitsorganisation (WHO) die Einteilung menschlicher und tierischer Tumore vorgenommen hat. Dabei werden die Eigenschaften des Primärtumors (T), Veränderungen der regionalen Lymphknoten (N) und das Vorhandensein von Metastasen (M) dokumentiert (KESSLER, 1999a).


2.1.3 Diagnose und Therapie
Da die meisten Besitzer keine routinemäßige Inspektion der Maulhöhle vornehmen, werden viele Tumore erst
in einem sehr späten Stadium diagnostiziert. Häufige klinische Anzeichen sind dabei Verformungen des Gesichts
und des Unterkiefers, Foetor ex ore, verminderte Futteraufnahme, anhaltender Speichel- oder Blutfluss,
Zahnfehlstellungen und Zahnverlust (LIPTAK u. WITHROW, 2007;NOLTE u. NOLTE, 2000e).
Identifizierung des Tumortyps zu erreichen. Hilfsmöglichkeiten sind hierbei unter anderem (u.a.) Adspektion, Palpation, Röntgen, CT, MRT, Ultraschall, Endoskopie, sowie Feinnadelaspiration oder Biopsie und deren zytologischer und histologischer Untersuchung. Den wichtigsten Schritt der Diagnosestellung einer Tumor-erkrankung stellt die Biopsie mit anschließender histologischer Untersuchung dar, denn nur so kann man das biologische Verhalten des Tumors einschätzen und eine Stadieneinteilung der Erkrankung vornehmen (KESSLER, 1999a; WHITE, 1998a).
Um die beste Wahl der Therapie treffen zu können, ist es sehr wichtig, eine möglichst genaue Anschließend wählt man unter den Therapiemöglichkeiten wie Chirurgie, Bestrahlung, Chemotherapie und Hyperthermie die geeignetste aus, wobei oft auch Kombinationstherapien eingesetzt werden (MORRISON, 1998c; WHITE, 1998b).
2.1.4 Prognose
Die Prognose ist von einigen Faktoren wie histopathologischer Typ des Tumors, dessen Größe,
Knochenbeteili
gung, Bildung von Metastasen in die regionalen Lymphknoten, Bildung
von Fernmetastasen, Lage innerhalb des Mund-Rachen-Raums und dem
Krankheitsstadium abhängig (WHITE, 1998b).
Eine sehr schlechte Prognose haben z.B. Primärtumore wie Melanome, die schon sehr groß sind und sich im caudalen Teil der Maulhöhle befinden oder eine Knochenbeteiligung, regionale Metastasen oder Fern- metastasen aufweisen (WHITE, 1998b). Grundsätzlich sind die Prognose und die Überlebenszeiten immer besser, wenn der Tumor in einem sehr frühen Stadium diagnostiziert und der Patient sehr rasch therapiert wurde (NORTH u. BANKS, 2009a).
2.2. Strahlentherapie
2.2.1 Entwicklung der Strahlentherapie in der Veterinärmedizin
Strahlentherapie ist nicht nur in der Humanmedizin, sondern auch in der Tiermedizin eine effektive Möglichkeit zur Behandlung von Tumorpatienten.
Radiotherapie wurde in der Veterinärmedizin schon genutzt, kurz nachdem der Physiker W.C. Röntgen 1895 die
Röntgenstrahlen entdeckt hatte (ESTRIN, 2009). In den Jahren 1895 bis 1920 sammelte bereits der deutsche Veterinärmediziner
Richard Eberlein erste Erfahrungen bei der Behandlung von Haustieren. Der folgende große technische Fortschritt
und das bessere Verständnis der radiobiologischen Effekte führten dazu, dass der österreichischeVeterinärmediziner
Alois Pommer erste Radiotherapieprotokolle für die Tiermedizin
entwickelte, die er ab dem Jahr 1934 bei Kongressen weltweit vorstellte. Durch neuere Erkenntnisse über
das Verhalten von normalen Gewebe und Tumorgewebe auf Radiotherapie,sowie durch die Entwicklung modernerer Bestrahlungsgeräte, entstanden im Laufe
der Zeit jedoch bessere Versionen von Behandlungs-protokollen (BUCHHOLZ u. LUDEWIG, 2009; LaRUE u. GILLETTE, 2007).
Heutzutage nutzen immer mehr Tierärzte die Möglichkeit ihre Patienten, für eine Radiotherapie, an entsprechende Spezialkliniken zuzuweisen, wodurch die Verwendung der Strahlentherapie für die
Behandlung eines Tumors zunehmend Bedeutung erlangt. Es ist jedoch sehr wichtig, die biologischen und physikalischen Prinzipien der Strahlentherapie und ihre Wirkung auf Gewebe genau zu kennen,
um den Tumor optimal zu behandeln und um
eine Übertherapie mit Nebenwirkungen zu verhindern (THRALL, 1998).
2.2.2 Physikalische Grundlagen der Radiotherapie
Bei der Behandlung eines Tumors mit ionisierender Strahlung, nutzt man deren Fähigkeit,
Zellen abzutöten (KASER-HOTZ, 1999).
Es wird gezielt Energie in der Nähe der DNA deponiert, entweder in Form von
elektromagnetischer (Photonen) oder partikulärer (Elektronen) Strahlung. Durch den
Compton-Effekt kommt es bei den Photonen zu einer Interaktion zwischen ihnen und dem
Gewebe auf atomarer Ebene, wodurch nach Ejektion eines Elektrons aus dem atomaren
Verbund ein freies, energiegeladenes (kinetisches) Elektron und ein positiv geladenes Atom
entsteht. Angegeben wird die Energie der ionisierenden Strahlung mit der Einheit 1 Gray (Gy)
und entspricht der Energie von 1 J/kg (DOBSON, 1998b; SIMON, 2000a).
Die durch die Strahlenenergie freigesetzten kinetischen Elektronen können dann entweder zu
einer direkten Schädigung der DNA in Form von Doppelstrangbrüchen führen, oder indirekt,
durch die Bildung freier Sauerstoffradikale aus H2O, eine Unterbrechung des DNA-Stranges
bewirken (KASER-HOTZ, 1999; SIMON, 2000a).
Bei diesem Zelltod, der nach einigen Stunden bis Tagen eintritt, unterscheidet man zwischen
einem mitotischen Zelltod und einem Interphasentod. Beim mitotischen Zelltod werden die
Zellen während der Zellteilung geschädigt und dies betrifft v.a. sich schnell teilende
Zellpopulationen wie Magen-Darmtrakt, Haut, Knochenmark und Tumorzellen. Unter
Interphasentod versteht man eine Zelllysis unabhängig von der Zellteilung. Es kann bei
ausreichend hoher Strahlendosis (>5 Gy) somit jede Zellart betreffen (DOBSON, 1998b;
KASER-HOTZ, 1999; SIMON, 2000a).
2.2.3 Technische Grundlagen
Für die Durchführung einer Strahlentherapie gibt es verschiedene Möglichkeiten, wie die
Teletherapie, Brachytherapie oder systemische Radiotherapie.
Die am häufigsten angewendete Form ist die Teletherapie, bei der die Energie über eine
äußere Strahlenquelle abgegeben wird, die sich in einigem Abstand zum Patienten befindet.
Möglichkeiten für die Energiequellen sind orthovoltage Röntgengeneratoren, oder
megavoltage Kobalt- und Cäsiumquellen, sowie Linearbeschleuniger (LaRUE u. GILLETTE,
2007; NORTH u. BANKS, 2009b; SIMON, 2000a).
An der Veterinärmedizinischen Universität Wien wird ein Linearbeschleuniger verwendet, da
er einige Vorteile mit sich bringt. Zum einen kann er sowohl Röntgenstrahlen als auch
Elektronen unterschiedlicher Energie produzieren und zum anderen liefert er 6-10 mal mehr
Energie als anderen Strahlenquellen, wodurch eine höhere Penetrabilität, eine geringere
Streustrahlung und eine gleichmäßigere Verteilung der Energie im Gewebe erreicht wird. Ein
weiterer Vorteil liegt darin, dass die maximale Energiedosis bis einige cm unterhalb der
Dermis liegt, wodurch es zu einer Schonung der Hautstrukturen und Verminderung der
kutanen Nebenwirkungen kommt. Durch diesen Dosis-Aufbaueffekt im Gewebe können
höhere Strahlendosen verwendet und bessere Therapieergebnisse erzielt werden
(LaRUE u. GILLETTE, 2007; SIMON, 2000a; THRALL, 1998).
2.2.4 Radiosensitivität
Die Zellproliferation ist ein zyklischer Prozess und lässt sich in bestimmte Phasen gliedern:
die S-Phase (DNS-Synthese), M-Phase (Mitose), G1-Phase und G2-Phase (Teilung), sowie
die G0-Phase (Ruhephase). Wichtig in der Behandlung von Krebs ist zu beachten, dass die
Zellen in den einzelnen Phasen unterschiedliche Sensitivität gegenüber Bestrahlung und auch
Chemotherapeutika aufweisen (KASER-HOTZ, 1999; LaRUE u. GILLETTE, 2007).
Grundsätzlich gilt, dass sich Zellen, die sich im Zellzyklus aktiv in den Teilungsphasen G1,
G2 und Mitose befinden und die sogenannte Wachstumsfraktion bilden, am empfindlichsten
gegenüber Strahlen verhalten. Das heißt also je höher der Anteil der Zellpopulation ist, der die
Wachstumsfraktion bildet, umso höher ist die Radiosensitivität des Gewebes. Zellen in der
S-Phase hingegen, sind am resistentesten. Dies erklärt auch, dass bei Geweben mit rascher
Proliferation wie z.B. Mukosa, Haut, Knochenmark und bei den meisten Tumoren,
Strahlenschäden schon nach wenigen Tagen bis Wochen sichtbar werden. Bei langsam oder
nichtproliferierendem Gewebe (z.B. Nervengewebe, Knochen, Muskulatur, Lunge) hingegen
erst nach Monaten oder Jahren (KASER-HOTZ, 1999; SIMON, 2000a).
Aber auch die Anwesenheit von Sauerstoff im bestrahlten Gewebe hat einen großen Einfluss
auf den Effekt der Radiotherapie. Sauerstoff verbindet sich mit den durch die Strahlung
entstehenden freien Radikalen und bildet sogenannte organische Peroxide. Diese sind stabiler
als freie Radikale und können die DNA-Schädigung somit verstärken (oxygen enhancement).
Daraus ergibt sich, dass hypoxische Zellverbände 2-3 mal weniger strahlensensitiv sind.
Gerade große Tumore weisen einen hohen Anteil hypoxischer Bereiche auf, wodurch sie
dadurch oft resistent gegenüber einer Strahlentherapie werden (DOBSON, 1998b; SIMON,
2000a; THRALL, 1998).
2.2.5 Biologische Grundlagen
Wichtig ist, dass die Strahlung so eingesetzt wird, dass die Schäden im Tumorgewebe
deutlich größer sind als im normalen gesunden Gewebe. Von dem her wird die Gesamtdosis
nicht auf einmal, sondern in kleinen Einzeldosen, sogenannten Fraktionen verabreicht.
Denn nach einer einzelnen kleinen Strahlendosis sind ein Teil der Zellen der Population
abgestorben, die anderen hingegen haben nur subletale Schäden davon getragen, die durch
körpereigene Zellmechanismen schnell wieder repariert werden können. Grundsätzlich gilt,
dass die Regenerationsfähigkeit bei gesunden Zellen besser ist als bei tumorösen Zellen,
wodurch idealerweise zwischen den Behandlungseinheiten eine Reparation normaler Zellen,
nicht aber von Tumorzellen stattfindet (DOBSON, 1998b; KASER-HOTZ, 1999).
Ein weiterer wichtiger Schritt, der durch eine Fraktionierung erreicht werden kann, ist die
Redistribution, d.h. die Neuverteilung von Tumorzellen in bestimmte Phasen des Zellzyklus.
Während der Bestrahlung werden v.a. Tumorzellen aus den radiosensitiven G1-, G2- und M�Phasen des Zellzyklus geschädigt. In den Behandlungspausen treten aber durch den
Zellverlust Zellen aus den strahlenresistenten S- und G0- Phasen in die sensitiven Phasen
über, wodurch mit der nächsten Fraktion diese dann wieder geschädigt werden können
(DOBSON, 1998b; LaRUE u. GILLETTE, 2007).
Einen sehr großen therapeutischen Nutzen zieht man aus der Reoxygenierung hypoxischer
Tumorzellen in den Behandlungspausen zwischen den einzelnen Fraktionen. Wie schon
erwähnt, sind hypoxische Zellen weniger strahlenempfindlich als gut oxygenierte. Da
Tumorgewebe häufig eine mangelnde Blutgefäßversorgung besitzen, weisen die Zellen in
einigen Arealen des Tumors eine schlechte Sauerstoffversorgung auf. Bei einer
Bestrahlungseinheit stirbt aber ein Teil der gut oxygenierten Zellen ab, wodurch die
Sauerstoffversorgung der verbliebenen Zellen verbessert wird und diese dann mit der
nachfolgenden Behandlung abgetötet werden können (DOBSON, 1998b; KASER-HOTZ,
1999).
Die schwierigste Aufgabe der Veterinärmediziner liegt nun darin, die richtige Art der
Fraktionierung festzulegen. Der Erfolg einer Behandlung eines Tumors durch Strahlung hängt
von der applizierten Gesamtdosis ab. Jedoch muss bedacht werden, dass je höher die Dosis
der Fraktion ist, desto mehr Schäden treten auch im normalen Gewebe auf. Auch dürfen die
Zeiträume zwischen den Fraktionen nicht zu groß sein, da es sonst zu einer Repopulation des
Tumors kommen kann (DOBSON, 1998b; LaRUE u. GILLETTE, 2007; SIMON, 2000a).
Berücksichtigt man nun diese von Whiters 1975 eingeführten „4 R“ (Reparation,
Redistribution, Reoxygenierung und Repopulation) sind tägliche Fraktionen mit niedrigen
Strahlendosen besser als wenige Fraktionen mit hoher Dosis, da man so die größtmögliche
Gesamtdosis mit den geringsten Nebenwirkungen erreichen kann.
(FOALE u. DEMETRIOU, 2010).
2.2.6 Klinische Anwendung der Radiotherapie
Eine Behandlung von Tumoren mittels einer Strahlentherapie ist v.a. indiziert bei malignen
Neoplasien, die aufgrund infiltrativen Wachstums oder ihrer Größe chirurgisch nicht
beherrscht werden können, ohne dass funktionelle oder auch kosmetische Dysfunktionen
auftreten. Dies ist gerade bei Maulhöhlentumoren des Öfteren der Fall (DOBSON, 1998b;
KASER-HOTZ, 1999).
Wichtig ist, dass man sich vor Beginn der Behandlung sehr gründlich über die vorliegende
Tumorart und dessen Radiosensitivität informiert, denn nicht alle Tumore reagieren gleich gut
auf ionisierende Strahlung (ESTRIN, 2009).
Grundsätzlich unterscheidet man zwischen einer kurativen und einer palliativen
Bestrahlungstherapie und innerhalb der palliativen Protokolle zwischen täglich fraktioniert
und hypofraktioniert.
Das Ziel der kurativen Behandlung liegt darin, eine längerfristige Kontrolle des Tumors, eine
Verlängerung der Überlebenszeit des Patienten oder sogar in seltenen Fällen eine Heilung zu
erreichen (DOBSON, 1998b; SIMON, 2000a).
Bei schon sehr fortgeschrittenen Tumorstadien, die oft inoperabel sind und bereits lokale
Veränderungen und teilweise Metastasen aufweisen, wird eine palliative Therapie
durchgeführt. Hier liegt das Ziel nicht in einer Heilung oder Verlängerung der Überlebenszeit,
sondern in einer Verbesserung der Lebensqualität, der Körperfunktionen und der Linderung
von Schmerzen (LaRUE u. GILLETTE, 2007; SIMON, 2000a).
Wie im vorherigen Punkt erwähnt, werden die Patienten bei den gängigen kurativen
Protokollen meist täglich bestrahlt mit einer höheren Anzahl an Fraktionen, aber einer
niedrigeren Einzeldosis. Werden die Tiere palliativ täglich fraktioniert behandelt, erhalten sie
wenige Einzelfraktionen und eine niedrige Einzel- sowie Gesamtdosis.
Bei der hypofraktionierten Bestrahlung hingegen, die bei bestimmten Tumoren, wie z.B. in
der Maulhöhle beim Malignen Oralen Melanom, verwendet wird, werden die Tiere mit nur
4-6 Einzelfraktionen, in einem wöchentlichen oder 2x pro Woche durchgeführtem Intervall
und hohen Einzeldosen bestrahlt. Vorteile dieser Bestrahlungsart liegen in einer niedrigeren
Anzahl an Narkosen für das Tier, niedrigere Kosten und weniger Aufwand für den Besitzer,
sowie weniger akuten Nebenwirkungen als bei einer hyperfraktionierten Behandlung. Da sie
jedoch gegen einige Grundsätze der „4R‘s“ verstößt und das Risiko von unerwünschten
Spätnebenwirkungen erhöht ist, sollte diese Art der Therapie nur bei bestimmten Tumorarten
verwendet werden (FOALE u. DEMETRIOU, 2010).
2.2.7 Nebenwirkungen der Radiotherapie
Wie schon erwähnt, reagieren aber nicht nur Tumorzellen auf die zerstörende Wirkung der
Strahlentherapie, sondern auch normale Zellen die sich im Bestrahlungsfeld
befinden.
Dadurch kann es zu unerwünschten akuten und chronischen Effekten kommen.
Akute Nebenwirkungen treten v.a. bei sich schnell teilenden Zellen wie Schleimhaut oder
Haut während der Zellteilung auf und sind dosisabhängig. Grundsätzlich heilen sie aber meist
2-3 Wochen nach Abschluss der Behandlung wieder ab. Chronische Effekte werden erst
mehrere Monate bis Jahre nach der Behandlung sichtbar und treten überwiegend bei sich
langsam teilenden oder nicht proliferierenden Zellpopulationen wie Knochen, Lunge oder
zentrales Nervensystem auf (LaRUE u. GILLETTE, 2007; SIMON, 2000a; THRALL, 1998).
Da sich im Bestrahlungsfeld von Maulhöhlentumoren v.a. Gewebe wie Haut und Schleimhaut
befinden, überwiegen die akuten Nebenwirkungen und äußern sich in Form einer Mukositis,
Erythembildung, Ödematisierung und Desquamation im Bereich des Strahlenfeldes
(SIMON, 2000a; MORRIS u. DOBSON, 2001c).
2.3. Kombinationstherapien
Radiotherapie ist für sich gesehen bei einigen Tumorerkrankungen eine effektive
Behandlungsmöglichkeit. Jedoch gibt es auch Fälle, die durch Bestrahlung allein nicht in den
Griff zu bekommen sind. Bei ihnen wird eine Kombination mit weiteren
Behandlungsmöglichkeiten wie Chirurgie und Chemotherapie empfohlen (LaRUE u.
GILLETTE, 2007; MORRIS u. DOBSON, 2001b; SIMON 2000a).
2.3.1. Chirurgie
Chirurgie ist eine der wichtigsten und ältesten Formen der Krebsbehandlung und hat in der
Veterinärmedizin einen sehr hohen Stellenwert, da weitere Behandlungsmöglichkeiten wie
Bestrahlung und Chemotherapie nicht immer zur Verfügung stehen. Von großer Bedeutung
ist jedoch, dass vor der chirurgischen Tumorresektion, mit Hilfe einer Biopsie und
histologischen Untersuchung, eine genaue Einteilung des Tumors in Typ, Grad und Stadium
gemacht wird, denn nicht bei allen Tumortypen muss eine radikale Chirurgie die beste
Lösung sein (KESSLER, 1999b; NOLTE u. NOLTE, 2000c; SALISBURY, 1998a).
Grundsätzlich wird eine kurative Chirurgie angestrebt, bei der man allein durch eine
vollständige Resektion eine Heilung der Tumorerkrankung erzielen kann. Denn wie schon
COYLE u. GARRETT in einer Studie von 2009 erwähnten, weist eine komplette chirurgische
Tumorentfernung eine signifikant längere Überlebenszeit auf, als eine inkomplette
Entfernung.
Unter einer palliativen Chirurgie versteht man die Tumorresektion mit dem Ziel der
Verbesserung der Lebensqualität, nicht aber der Heilung oder Lebenszeitverlängerungen.
Außerdem gibt es noch eine sogenannte zytoreduktive Chirurgie, die durchgeführt wird, wenn
keine vollständige Exzision des Tumors möglich ist. Jedoch ist sie nur sinnvoll und
lebenszeitverlängernd, wenn man die Möglichkeiten für zusätzliche Therapieformen wie
Bestrahlung- oder Chemotherapie hat, um einer schnellen Rezidivbildung entgegenzuwirken
(KESSLER, 1999b; WHITE, 1998a).
So kann z.B. die Radiotherapie entweder präoperativ (neoadjuvant) oder postoperativ
(adjuvant) eingesetzt werden. Präoperativ ist das Ziel eine Tumorverkleinerung und daraus
resultierend eine erleichterte oder erst dadurch mögliche Operation. Postoperativ steht das
Abtöten der mikroskopischen Resttumorpopulation und die Minimierung des Rezidivrisikos
im Vordergrund (NOLTE u. NOLTE, 2000c; DOBSON, 1998b; SALISBURY, 1998a).
Da maligne Maulhöhlentumore schon sehr früh die Tendenz zur Invasion der Kieferknochen
und des Periosts zeigen, ist es oft nötig eine radikale Chirurgie, das heißt eine Resektion des
betroffenen Kiefersegments, durchzuführen. Je nach anatomischen Gegebenheiten und
Wachstumsverhalten kann der Chirurg zwischen verschiedenen Methoden der
Mandibulektomie und Maxillektomie auswählen (LIPTAK u. WITHROW, 2007; NOLTE u.
NOLTE, 2000c; SALISBURY, 1998b).
Trotz all dieser radikalen Methoden ist es wichtig, das Metastasenrisiko von Tumoren zu
kennen, denn es können auch nach erfolgreicher chirurgischer Resektion Metastasen
entstehen. Daher ist es in einigen Fällen sinnvoll, adjuvante oder neoadjuvante Therapien in
den Behandlungsplan miteinzubeziehen. Dabei wird die Bestrahlungstherapie v.a. bei
Primärtumoren und regionalen Metastasen und die Chemotherapie bei Fällen mit
systemischen Metastasen eingesetzt (DOBSON 1998b; SIMON, 2000a).
2.3.2. Chemotherapie
Die Bestrahlungstherapie wird auch sehr häufig mit verschiedenen zytotoxischen Substanzen
kombiniert, die vor, während oder nach der Bestrahlung eingesetzt werden, da einige von
ihnen die Reaktion des Gewebes auf Bestrahlung modifizieren können. Man kombiniert hier
also eine lokale mit einer systemischen Behandlung, um eine bessere Tumorkontrolle und
somit Therapieergebnisse zu erzielen. Chemotherapeutika können nämlich sowohl die
Reparation subletaler Zellschäden verhindern, radioresistente Zellen in der S- und G0- Phase
des Zellzyklus zerstören, als auch Mikrometastasen außerhalb des Bestrahlungsfeldes
bekämpfen (KESSLER, 1999c; NOLTE u. NOLTE, 2000d).
Wie bei allen anderen Therapiemethoden steht auch bei der Chemotherapie die genaue
Identifikation des Tumors an erster Stelle. Denn es gibt Tumore, die nur auf bestimmte
Zytostatika ansprechen, aber auch welche die gar nicht empfindlich sind (GORMAN; 1998;
MORRISON, 1998; NOLTE u. NOLTE, 2000d).
Grundsätzlich wirken Chemotherapeutika v.a. auf sich aktiv teilende Tumorzellen, denn
während dieser Wachstumsphasen reagieren die Zellen am empfindlichsten auf externe
Schädigungen. Zu beachten ist jedoch, dass sich der Anteil der sich teilenden Zellen eines
Tumors im Laufe seines Wachstums ändert. Zum Zeitpunkt der Entstehung des Tumors ist,
laut der sogenannten Gompertzschen Kinetik, dieser Anteil hoch, erreicht dann ein Plateau
und geht schließlich in einen Zustand über, bei dem der Anteil der nicht teilungsaktiven
Zellen überwiegt. Daraus ergibt sich, dass die Therapie so früh wie möglich begonnen werden
soll, denn je kleiner der Tumor, desto empfindlicher ist er (KESSLER, 1999c; NOLTE u.
NOLTE, 2000d).
Natürlich werden aber auch die normalen, sich rasch teilenden Gewebe des Körpers durch die
Chemotherapie geschädigt, wodurch u.a. Nebenwirkungen wie Myelosuppression,
Immunsuppression, gastrointestinale Nebenwirkungen und Störung der Zellerneuerung von
Haut und Schleimhaut auftreten können. Da deren Stärke abhängig von Art, Dosis und
zeitlicher Abfolge der Medikamentengabe ist, besteht die Hauptaufgabe der Tierärzte darin,
die Dosis so zu wählen, dass sie eine signifikante Wirkung auf die Zellen des Tumors, nicht
aber auf normale Zellen hat. Außerdem muss der Abstand zwischen den Behandlungen so
berechnet werden, dass zwar genügend Tumorzellen abgetötet werden, normale
Zellpopulationen aber die Zeit haben sich wieder zu erholen. Wobei der Abstand nicht zu
groß sein darf, da es ansonsten zu einer Repopulation des Tumors aus verbliebenen
Tumorzellen kommen kann (GORMAN, 1998; NOLTE u. NOLTE, 2000d).
Innerhalb der Zytostatika unterscheidet man zwischen phasenspezifischen Medikamenten, die
die Zellen nur während bestimmter Phasen des Zellzyklus schädigen, zellzyklusabhängige
Mittel, die während mehrerer Phasen angreifen können und zellzyklusunabhängigen
Chemotherapeutika, die sowohl sich teilende als auch ruhende Zellen schädigen können
(SIMON, 2000b).
Die bevorzugte Form der Behandlung ist eine kombinierte Chemotherapie, bei der
verschiedene Medikamente eingesetzt werden. Der Vorteil liegt darin, dass sie verschiedene
Stadien des Zellzyklus beeinflussen und dadurch eine größere Anzahl an Tumorzellen
abgetötet wird. Außerdem erlaubt dies die Anwendung von niedrigeren Dosierungen,
wodurch die Toxizität für normales Gewebe gesenkt wird (GORMAN, 1998; KESSLER,
1999c).
Im Folgenden wird nur kurz auf die Medikamente eingegangen, die auch in dieser Studie
zusätzlich zur Bestrahlungstherapie verwendet wurden.
Cyclophosphamid gehört zur Gruppe der alkylierenden Medikamente, mit der Eigenschaft,
dass sie ein Wasserstoffatom durch eine Alkylgruppe ersetzen. Durch diese Alkylierung
kommt es zu Brüchen im DNS-Molekül, zu Querverbindungen im DNS-Doppelstrang und
somit zur Störung der DNS- aber auch der RNS- Transkription. Diese Wirkung ist
zellzyklusunabhängig. Hauptindikationen für Cyclophosphamide sind u.a. bei malignen
Lymphomen, Karzinomen, Sarkomen und Leukämien (CHUN et al., 2007; GORMAN, 1998;
SIMON, 2000b).
Auch Melphalan schließt sich dieser Gruppe von Zytostatika an und wird v.a. zur Behandlung
des multiplen Myeloms eingesetzt (CHUN et al., 2007; SIMON, 2000b).
Carboplatin ist eine Platinverbindung mit einer alkylanzien ähnlichen,
zellzyklusunabhängigen Wirkung und reagiert mit den Basen der DNA, wodurch auch hier
wieder die normale Funktion und Replikation der DNS gestört wird. Eingesetzt wird dieses
Medikament bei verschiedenen Karzinomen und Sarkomen (GORMAN, 1998; SIMON,
2000b).
Doxorubicin gehört zur Gruppe der Antitumor-Antibiotika und wird aus dem Pilz
Streptomyces pencetus var. caesius gewonnen. Diese Stoffe lagern sich zellzyklusunabhängig
zwischen die Nukleotide ein und bilden so stabile Komplexe mit der DNS und RNS, wodurch
deren Funktion beeinträchtigt wird. Angewendet wird Doxorubicin v.a. bei Lymphomen,
verschiedenen Karzinomen und Sarkomen (RUSLANDER, 1999; SIMON, 2000b).
Vinorelbin zählt zu den Pflanzenalkaloiden (Spindelgiften) und entstammt aus der
immergrünen Pflanze Catharantus roseus. Es bindet spezifisch an das Tubulin in den
Mikrotubuli und verhindert so die Ausbildung der mitotischen Spindel, wodurch es zur
Hemmung der Mitose kommt. Somit hat Vinorelbin eine zellzyklusabhängige Wirkung auf
sich teilende Zellen, v.a. in der M-Phase und wird zur Behandlung von Lymphomen,
Mastzelltumoren, Karzinomen und Sarkomen eingesetzt (SIMON, 2000b).
2.4 Übersicht über die häufigsten bestrahlten Tumore in der Maulhöhle
Die häufigsten Tumore in der Maulhöhle der Hunde sind orale maligne Melanome,
Plattenepithelkarzinome und Sarkome (v.a. Fibrosarkome). Bei den Katzen dominieren
Plattenepithelkarzinome mit 70 % aller Maulhöhlentumore (KLEIN, 2010), gefolgt von
Fibrosarkomen, Osteosarkomen und oralen malignen Melanomen. Zu finden sind die Tumore
in der Maulhöhle v.a. in der Gingiva, den Zahnalveolen, den Tonsillen, den Lefzen, der
Backenschleimhaut, dem Gaumen und der Zunge (LIPTAK u. WITHROW, 2007; NOLTE u.
NOLTE, 2000e; WHITE, 1998b).
2.4.1 Orale maligne Melanome (OMM)
Das orale maligne Melanom ist ein sehr bösartiger, aggressiver Tumor der Pigmentzellen
(Melanozyten) der Basalschicht der Epidermis oder des Gingivaepithels, mit der Tendenz
lokal invasiv zu wachsen und frühzeitig lymphogen und hämatogen v.a. in die regionalen
Lymphknoten und die Lunge zu metastasieren (KESSLER, 1999e; WHITE, 1998b).
Innerhalb der Hunde stellen OMM mit 30-40 % aller oraler Tumore, die häufigste Neoplasie
der Maulhöhlenschleimhaut dar (CRONIN, 2006a).
Studien haben ergeben, dass v.a. ältere Tiere, mit einem Durchschnittsalter von elf Jahren,
Rassen wie Dackel, Cocker Spaniel und Pudel und vermehrt Rüden betroffen sind.
Makroskopisch zeigen sich 2/3 der Tumore pigmentiert, 1/3 pigmentlos oder – arm, mit einer
fleischigen, häufig ulzerierten und nekrotischen Oberfläche.
Durch ihr hochmalignes Verhalten sind eine gründliche Untersuchung des Patienten und eine
Stadieneinteilung, nach dem Schema der WHO entscheidend für die Therapiewahl. So ist z.B.
chirurgisch gesehen, durch die meistens schon vorhandene Infiltration des Kieferknochens
oder Periosts, eine Resektion des betroffenen Kiefersegments
(Mandibulektomie/Maxillektomie) nötig. Grundsätzlich sind OMM wenig strahlensensitiv,
aber durch die Anwendung hoher Einzeldosen (Hypofraktionierung) kann eine lokale
Tumorkontrolle erreicht werden (KESSLER, 1999e; NOLTE u. NOLTE, 2000e).
Die besten Erfolge erzielt man mit einer lokalen Therapie durch eine chirurgische
Zytoreduktion mit anschließender Radiotherapie und einer systemischen Chemotherapie mit
Cisplatin oder Carboplatin (CRONIN, 2006b; KESSLER, 1999e).
Trotz Therapie kann die Metastasenbildung, durch das sehr aggressive Verhalten, in vielen
Fällen nicht verhindert werden, was prognostisch zu einer schlechten Langzeitüberlebensrate
führt (LIPTAK u. WITHROW, 2007; NOLTE u. NOLTE, 2000e).
Katzen sind im Gegensatz zu Hunden eher selten betroffen. Prädisponiert sind auch wieder
ältere Tiere. Grundsätzlich verhält sich das OMM vom klinischen Erscheinungsbild und
biologischen Verhalten her wie beim Hund (KESSLER, 1999e; LIPTAK u. WITHROW,
2007).
2.4.2 Plattenepithelkarzinome (Squamous Cell Carcinoma, SCC)
Auch die SCC gehören zu den häufigsten Maulhöhlentumoren bei Hunden und Katzen. Es
handelt sich um epitheliale Neoplasien, die aus den Plattenepithelzellen der Epidermis
entstehen und die darunter liegende Dermis und Subkutis infiltrieren. Man kann zwischen
einer produktiven Form mit papillärem, blumenkohlartigem Wachstum und einer erosiven
Form mit flachem Ulkus und erhöhtem Rand unterscheiden. Am häufigsten findet man sie an
der Gingiva und den Zahnalveolen, sowie an den Tonsillen und der Zunge. Wobei die beiden
letztgenannten Lokalisationen ein viel aggressiveres Verhalten mit einer sehr hohen
Metastasierungsneigung zeigen und daher eine schlechtere Prognose aufweisen
(KESSLER, 1999e; WHITE, 1998b).
Bei den Hunden stellen sie nach den OMM mit 17-25 % die zweithäufigsten malignen
Tumore der Maulhöhle dar (COYLE u. GARRETT, 2009b; CRONIN, 2006a). Es sind v.a.
Tiere mit einem Durchschnittsalter von neun Jahren betroffen, wobei es keine Rassen- und
Geschlechtsprädispositionen gibt. Klinisch gesehen zeigt sich das gingivale SCC meist an der
rostralen Mandibula mit einer roten, stets ulzerierten, erhabenen bis blumenkohlartigen
Oberfläche und häufig durch Invasion des Kieferknochens auch mit Zahnlockerung und
Zahnverlust (KESSLER, 1999e; NOLTE u. NOLTE, 2000e).
Therapie der Wahl ist eine radikale chirurgische Therapie mit einer Kieferresektion, um eine
Rezidivbildung zu vermeiden. Da sie aber sowohl zu den strahlensensitiven Tumoren
gehören, als auch auf Chemotherapeutika wie Cisplatin oder Doxorubicin ansprechen, wird
gerade bei inoperablen Fällen bzw. unvollständigen Resektionen eine Kombinationstherapie
empfohlen (KESSLER, 1999e).
Linguale SCC machen die Hälfte aller lingualen Tumore bei Hunden aus und treten v.a. mit
einem Durchschnittsalter von 9,5 Jahren auf. Da sie aber ein sehr aggressives biologisches
Verhalten mit Invasion und Metastasierung zeigen, treten trotz radikaler chirurgischer
Therapie und adjuvanter Bestrahlung schnell Rezidive auf. Auch tonsilläre SCC, die vermehrt
bei männlichen Hunden mit einem Durchschnittsalter von zehn Jahren entstehen, zeigen
dieses sehr aggressive biologische Verhalten, wodurch auch hier die Prognose trotz Therapie
schlecht ist (KESSLER, 1999e; WHITE, 1998b).
Bei Katzen ist das SCC mit 70 % der dominierende Tumor der Maulhöhle (KLEIN, 2010)
und tritt wie beim Hund an der Gingiva, Zunge und an den Tonsillen auf.
Die gingivale Lokalisation kommt allerdings am häufigsten vor und dies v.a. bei Katzen
zwischen zehn und zwölf Jahren ohne Geschlechts- und Rasseprädisposition. Sie zeigen oft
klinische Symptome wie verminderte Futteraufnahme, Dysphagie, starken Mundgeruch,
vermehrten Speichelfluss, Schleimhautulzerationen und Nekrosen, sowie Zahnlockerung und
Zahnverlust durch infiltratives Wachstum in den betroffenen Kieferknochen. Durch das stark
invasive Wachstum, die hohe Rezidivneigung und das zum Zeitpunkt der Diagnose meistens
schon weit fortgeschrittene und dadurch oft inoperable Stadium des Tumors, ist, unabhängig
von der Therapie, die Prognose sehr schlecht. Eine Möglichkeit, die Lebensqualität zu
verbessern, wäre eine palliative Therapie mit chirurgischer Teilresektion des Tumors und
adjuvanter Bestrahlung des OP Feldes und der regionalen Lymphknoten. Auch tonsilläre und
linguale SCC weisen eine sehr schlechte Prognose auf, da sie aufgrund des oft schon sehr weit
fortgeschrittenen Erkrankungsstadiums und der Lokalisation oft inoperabel sind und schlecht
auf Bestrahlung und Chemotherapie ansprechen. (KESSLER, 1999e; NOLTE u. NOLTE,
2000e).
2.4.3 Orale Fibrosarkome (orale FSA)
FSA zählen zu den mesenchymalen Tumoren und bilden eine charakteristische stark
vaskularisierte Pseudokapsel aus, die durch druckatrophiertes umliegendes Gewebe gebildet
wird. Sie treten häufig an der bukkalen und labialen Schleimhaut, am Gaumen und an der
Gingiva auf. Generell neigen orale FSA selten zur Metastasierung, jedoch zu stark
infiltrativem Wachstum und hoher Rezidivbildung. Therapie der Wahl ist auch hier eine
radikale chirurgische Exzision, da sie auf Strahlen- und Chemotherapie allein eher schlecht
ansprechen (KESSLER, 1999d; NOLTE u. NOLTE, 2000e). Wegen der starken
Rezidivneigung wird oft eine Kombinationstherapie mit einer Bestrahlung empfohlen
(COYLE et al.; 2009).
Diese bösartigen Tumore, ausgehend von den Fibrozyten, kommen bei den Hunden v.a. bei
größeren und mittleren Rassen, mit einem Durchschnittalter von sieben Jahren, sowie
vermehrt bei männlichen Tieren vor (KESSLER, 1999d; LIPTAK u. WITHROW, 2007;
WHITE, 1998b) und machen ca. 8-25 % aller oraler Tumore aus (COYLE et al., 2009).
Eine Lokalisationsprädisposition besteht für den harten Gaumen und die gingivale Mukosa im
Bereich zwischen Caninus und Prämolaren. Die Zubildungen sind knotig-derb, nicht
ulzerierend, eventuell brüchig und nekrotisch und können in den benachbarten Knochen
eindringen. Weniger als 25 % bilden Metastasen in die regionalen Lymphknoten und in die
Lunge. Da sie aber ein sehr stark invasives und destruktives Wachstum, sowie eine hohe
Rezidivneigung zeigen, ist eine radikale chirurgische Operation (Mandibulektomie/
Maxillektomie) zum frühestmöglichen Zeitpunkt mit adjuvanter Bestrahlungstherapie
anzuraten (KESSLER, 1999e; WHITE, 1998b).
Bei den Katzen gehören die FSA hinter den SCC zu den häufigsten Tumoren der Maulhöhle
und machen ca. 15 % aller Maulhöhlentumore aus (CRONIN, 2006a). Sie zeigen sich v.a. bei
älteren Tieren an der Gingiva und selten auch am harten und weichen Gaumen, wobei diese
Katzen mit klinischen Symptomen wie Zahnlockerung, Salivation und Foetor ex ore
vorgestellt werden. Das biologisches Verhalten, sowie die Therapieempfehlung, entspricht
weitgehend dem der Hunde (CRONIN, 2006a; KESSLER, 1999e; NOLTE u. NOLTE,
2000e).
2.4.4 Osteosarkome (OSA)
OSA sind die am häufigsten vorkommenden malignen Primärtumore des Knochens und
machen beim Hund sowie bei der Katze über 80 % aller Knochentumore aus. Es gibt sowohl
osteolytische, osteoproliferative, als auch gemischte Formen, wobei alle OSA des Schädels
eine geringe Neigung zur Metastasierung aufweisen (KESSLER, 1999f; NAGEL, 1999;
NOLTE u. NOLTE, 2000f).
OSA im Bereich des Kiefers treten v.a. bei Hunden <15 kg auf, mit einer Lokalisations�prädisposition an der Mandibula und Maxilla. Dabei sind gerade bei OSA der Maxilla
vermehrt weibliche Tiere mit einem Durchschnittsalter von neun Jahren betroffen.
Sie werden meistens vorgestellt aufgrund von Deformationen des Gesichtsschädels,
Exophthalmus, Schmerzen beim Öffnen des Mauls und Dysphagie. Als Therapie wird eine
radikale Exzision (Mandibulektomie/Maxillektomie) mit adjuvanter Chemotherapie
(Carboplatin, Doxorubicin, Cisplatin) empfohlen. Da OSA weitgehend strahlenresistent sind,
wird eine Strahlentherapie im Grunde nur für eine palliative Schmerztherapie bei inoperablen
Fällen eingesetzt. Bei frühzeitigem Therapiebeginn haben OSA eine durchaus günstige
Prognose (McGLENNON, 1998; NAGEL, 1999).
Bei den Katzen werden überwiegend ältere Tiere zwischen 8,5 und zehn Jahren, jedes
Geschlechts und jeder Rasse aufgrund von Zahnproblemen, Deformationen des Schädels,
ulzerativen Veränderungen in der Maulhöhle und Exophthalmus vorgestellt. Eine
Lokalisationsprädisposition besteht v.a. für den Oberkiefer. Wie beim Hund ist die Therapie
der Wahl eine radikale Chirurgie mit adjuvanter Chemotherapie (Doxorubicin) (KESSLER,
1999f).
2.4.5 weitere Tumore
Neben diesen sehr häufigen Tumoren der Maulhöhle gibt es noch viele weitere, die jedoch
seltener auftreten. Im Folgenden wird kurz auf die Neoplasien eingegangen, die in dieser
Studie einer Strahlentherapie unterzogen wurden.
Bei den Plasmozytomen, die auch als multiple Myeloma bezeichnet werden, handelt es sich
um Tumore der Plasmazellen oder ihren Vorstufen und gehören somit zu den B-Zell�Lymphomen. Im Kopfbereich treten sie v.a an der Maulschleimhaut, den Lefzen und den
Ohren, als solitäre, rötliche, erhabene Knoten mit einer glatten, manchmal ulzerierten
Oberfläche und einem Durchmesser von < 2cm auf. Bei den Hunden sind häufig Tiere mit
einem Durchschnittsalter von zehn Jahren betroffen, sowie Rassen wie Boxer, Cocker
Spaniel, Terrier, Schäferhunde und Schnauzer. Bei Katzen findet man Plasmozytome sehr
selten.
Grundsätzlich handelt es sich bei Plasmozytomen meist um benigne Tumoren, die mit einer
chirurgischen Exzision oft heilbar sind. Bei nicht resezierbaren Tumoren, Rezidiven oder
Metastasen hingegen, sollte man die Tiere mit Chemotherapeutika (Melphalan + Prednisolon)
behandeln und eventuell zur schnelleren Schmerzlinderung zusätzlich eine
Bestrahlungstherapie durchführen (KESSLER, 1999d; VAIL, 2007).
Ameloblastome gehören zu den odontogenen Tumoren und entwickeln sich aus den
Zahnanlagen. Sie treten v.a. bei Hunden zwischen drei und 13 Jahren auf. Generell gelten sie
als benigne und metastasieren nicht, aber verhalten sich dennoch lokal invasiv und destruktiv,
wodurch der Knochen stets mitbeteiligt ist. Sehr selten sind sie auch bei alten Katzen zu
finden. Als Therapie wird eine radikale Tumorresektion empfohlen, oder eine zytoreduktive
Operation mit adjuvanter Bestrahlung. Eine Bestrahlungstherapie alleine wäre zwar möglich,
jedoch ist dann das Risiko eines Rezidivs höher (KESSLER, 1999e; LIPTAK u. WITHROW,
2007).
Auch Odontome entstehen aus Anteilen des sich entwickelnden Zahnkeimes. Sie verhalten
sich lokal wenig invasiv, metastasieren nicht und sind oft abgekapselt. Sie treten bei Hunden
und Katzen sehr selten auf und dann aber v.a. in den caudalen Abschnitten der Mandibula und
Maxilla. Führt man eine Resektion des betroffenen Kiefersegmentes durch, ist die Prognose
durchaus als gut einzustufen (KESSLER, 1999e; NOLTE u. NOLTE, 2000e).
Selten findet man Tumore der Speicheldrüsen, sogenannte Adenokarzinome, v.a. der
Glandula parotis und mandibularis. Innerhalb der Hunde sind v.a. Cocker Spaniel mit einem
mittleren Alter von zehn Jahren betroffen und zeigen Symptome wie eine palpierbare
Umfangsvermehrung, Schmerzen, Dysphagie, Mundgeruch und Blutungen aus dem Maul.
Außerdem weisen 13 % der Patienten Metastasen in die regionalen Lymphknoten auf, sowie
10 % Lungenmetastasen. Bei den Katzen zeigen v.a. weibliche Siamkatzen im mittleren Alter
von zwölf Jahren dieses klinische Bild. Auch bei ihnen sind zum Zeitpunkt der Diagnose
bereits bei 1/3 der Patienten Lymphknotenmetastasen, sowie bei 20 % Lungenmetastasen
vorhanden. Die Therapie der Wahl ist, sowohl bei Katzen als auch bei Hunden, eine Chirurgie
mit adjuvanter Strahlentherapie und eventuell adjuvanter Chemotherapie. Wobei aber auch
eine Bestrahlung alleine eine gute lokale Tumorkontrolle und Verlängerung der
Überlebenszeit verspricht (HAMMER, 1999).
Leiomyosarkome gehören zu den Weichteilsarkomen und entwickeln sich aus Zellen der
glatten Muskulatur (BOY et. al, 2005). Sie erscheinen meist weiß, derb sowie lobuliert und
weisen ein hochaggressives Wachstum mit starker Metastasierungsneigung auf. Studien
haben ergeben, dass v.a. ältere Hunde betroffen sind, es aber keine Geschlechter- oder
Rasseprädisposition gibt. Auch bei diesen Tumoren wird als Therapie eine komplette
chirurgische Resektion empfohlen. Da sie eine mittelgradige Strahlensensitivität aufweisen,
kann bei inkompletter Entfernung mit einer adjuvanten Strahlentherapie eine lokale
Tumorkontrolle erreicht werden (NOLTE u. NOLTE, 2000g; LIPTAK u. FORREST, 2007).
3. Material und Methode
3.1 Patienten
In diese retrospektive Studie wurden Hunde und Katzen, die im Zeitraum von Jänner 2006 bis
Juni 2011 an der Veterinärmedizinischen Universität Wien aufgrund eines Maulhöhlentumors
bestrahlt wurden, aufgenommen.
Die gesamten Informationen über die Patienten wurden mit Hilfe des TIS
(Tierspitalinformationssystem), der Bestrahlungsaufzeichnungen und über die telefonische
Auskunft von den Tierbesitzern oder Haustierärzten erhoben.
So wurde für jeden Patienten u.a. die Nationale (Name, Spezies, Rasse, Geschlecht, Alter,
Gewicht), das Herkunftsland und der Überweisungsstatus ermittelt.
3.2 Krankheitsstatus
Um den Krankheitsstatus der Patienten genauer zu beschreiben, wurde zunächst ermittelt um
welche Tumorart (Orales Malignes Melanom , Fibrosarkom, Osteosarkom,
Spindelzellsarkom, Leiomyosarkom, Plattenepithelkarzinom, Adenokarzinom, Plasmozytom,
Odontom, Ameloblastom) es sich handelte und wo in der Maulhöhle der Tumor genau
lokalisiert war. Dabei stellte der P2 die Grenze zwischen rostral und caudal da und alles hinter
dem P2 wurde als caudal gewertet.
Zusätzlich wurde dokumentiert, ob bereits eine Beteiligung des Knochens oder der regionalen
Lymphknoten vorlag, wobei die regionale Lymphknotenmetastasierung mittels
Feinnadelaspirationsbiopsie (FNAB) oder Biopsie +/- Schnittbild ermittelt wurde. Hierbei
muss jedoch beachtet werden, dass die Diagnose für eine Metastasierung in die
Retropharyngeallymphknoten nur bildgebend gesichert wurde. Auch von Interesse war, ob es
sich um einen Primärtumor oder um ein Rezidiv handelte und falls Letzteres zutraf, wie oft
der Tumor schon nachgewachsen war.
3.3 Therapie
Alle Tiere in dieser Studie wurden mithilfe der Teletherapie behandelt. Für die Bestrahlungen
verwendete man Elektronenfelder im Energiebereich von 7-14 MeV und Photonenfelder mit
6MV, die mit Hilfe eines Linearbeschleunigers (Siemens Primus Midenergy) erzeugt wurden.
Folgende Behandlungsprotokolle kamen zum Einsatz:
1. Kurative Protokolle, bei denen die Patienten mit15-16 täglichen Einzelfraktionen, einer
Einzeldosis von 3,2 Gray (Gy) und einer Gesamtdosis von 48-51,2 Gy behandelt wurden.
Bei wenigen Patienten wurde die Einzeldosis auf 3,3, 3,5 oder 3,8 Gy modifiziert.
Außerdem wurde bei einem Hund mit einem lingualen Plattenepithelkarzinom ein
Behandlungsprotokoll mit 10 Einzelfraktionen, einer Einzeldosis von 4 Gy und einer
Gesamtdosis von 40 Gy angewendet. Bei diesem Patienten startete man zuerst mit einem
palliativen Protokoll, weitete dieses jedoch im Laufe der Behandlung auf ein modifiziertes
kuratives aus.
2. Innerhalb der palliativen Therapie unterscheidet man zwischen Protokollen die entweder
täglich fraktioniert oder hypofraktioniert, also ein bis zweimal pro Woche, eingesetzt
wurden.
Bei den täglich fraktionierten wurden die Patienten mit 4-7 Einzelfraktionen, Einzeldosen
von 3-6 Gy und einer Gesamtdosis von 20-28 Gy behandelt.
Die hypofraktioniert behandelten Tiere erhielten Protokolle mit 3-6 Einzelfraktionen,
Einzeldosen von 5-8 Gy und einer Gesamtdosis von 18-36 Gy.
Des Weiteren wurden folgende Daten erhoben: Behandlungszeit in Tagen, Anzahl der
Einzelfraktionen, Einzel- und Gesamtdosis, Feldäquivalent, Anzahl der Zielvolumina und die
Anzahl der verwendeten Felder innerhalb der einzelnen Zielvolumina. Sowie den Einsatz von
Blöcken, Keilen oder Bolusflaps zur Modifizierung der Bestrahlung, um das Bestrahlungsfeld
besser einzugrenzen oder die Eindringtiefe zu variieren und die Tatsache, ob ein
makroskopisch sichtbarer Tumor oder ein mikroskopisches Tumorvolumen nach
chirurgischer Resektion bestrahlt wurde.
Außerdem wurde bei allen Patienten vor Beginn der Behandlung dokumentiert, ob die
Bestrahlung postoperativ oder präoperativ stattfand, oder ob der Patient bereits im Vorhinein
mit einer Radiotherapie oder mit Chemotherapeutika behandelt wurde.
Innerhalb der Tiere bei denen der Tumor vor Beginn der Bestrahlung chirurgisch entfernt
wurde, betrachtete man noch einmal gesondert die Gruppe der frisch operierten. Bei Ihnen
wurde kein sauberer Schnittrand bei der Tumorentfernung erzielt, weshalb sie unmittelbar
nach Abheilung der Operationswunde bestrahlt wurden.
Bei den Patienten die man vor, neben oder nach der Bestrahlungstherapie mit
Chemotherapeutika behandelte, wurden zusätzlich die verwendeten Medikamente
festgehalten.
Auch das Auftreten akuter Nebenwirkungen wurde durch die Informationen im TIS ermittelt
und mit Hilfe der Richtlinien der VRTOG (Veterinary Radiationtherapy Oncology Group) in
4 verschiedene Schweregrade eingeteilt.
Nach dieser Sichtweise zeigen Patienten mit einem Grad 0 keine akuten Nebenwirkungen, mit
einem Grad 1 milde Veränderungen, mit einem Grad 2 moderate Reaktionen und mit einem
Grad 3 starke akute Reaktionen (LADUE u. KLEIN, 2001).
3.4 Follow up
Bei den makroskopischen Tumoren wurde, soweit Informationen im TIS vorhanden waren,
der Tumorstatus nach Ende der Bestrahlungstherapie ausgewertet. Dabei hat man zwischen
Remission, Progression und keine Veränderungen in der Tumorgröße unterschieden.
Weiteres wurde die Anzahl der Tiere die bis zum letzten Update am 30.04.2012 noch am
Leben waren ermittelt, sowie die Überlebenszeit in Tagen seit Ende der Bestrahlungstherapie.
Die Patienten, bei denen diese Informationen nicht erfasst werden konnten, galten ab dem
letzten Eintrag in ihrer Krankengeschichte als „lost“.
Mit Hilfe der Kaplan-Maier Methode wurde anschließend die mediane und mittlere
Überlebenszeit bestimmt, wobei die noch Lebenden und die „Lost-Patienten“ zensiert
wurden.
Die Todesursache der bereits verstorbenen Patienten wurde in folgende Kategorien eingeteilt:
1. lokale Tumorprogression
2. lokale Tumorprogression und Bildung systemischer Metastasen
3. Bildung systemischer Metastasen
4. andere Ursache aber nicht tumorassoziiert
Diese Informationen erhielten wir auch wieder mit Hilfe des TIS und telefonischer Auskünfte
der Tierbesitzer oder zuweisenden Tierärzte.
3.5 Statistische Methoden
Für die statistische Auswertung stand uns die Hilfe der Plattform Biostatistik des
Departements der Biomedizinischen Wissenschaften der Veterinärmedizinischen Universität
Wien zur Verfügung, die das Statistikprogramm SPSS verwendete. Dabei wurde zur
Auswertung der gesammelten Daten die deskriptive Statistik herangezogen.
Überlebenszeitanalysen wurden mit der Kaplan-Meier Methode durchgeführt, bei der, wie
schon im Punk 3.4 erwähnt, die noch lebenden und „lost“ gegangenen Patienten zensiert
wurden.
Außerdem wurde mit dem Log Rank Test getestet, wie sich die Überlebenszeiten hinsichtlich
Art der Behandlung, Tumorart, Tumorlokalisation, Knochenbeteiligung und Beteiligung der
regionalen Lymphknoten voneinander unterschieden.
4. Ergebnisse
In diese Studie wurden insgesamt 63 Tiere eingeschlossen, die im Zeitraum von Jänner 2006
bis Juni 2011 einer Bestrahlungstherapie aufgrund eines Maulhöhlentumors an der
Veterinärmedizinischen Universität Wien unterzogen wurden. Von diesen Patienten waren
82,5 % tierärztlich zugewiesen und 74,6 % stammten aus Österreich. Die restlichen Tiere
kamen aus Italien (15,9 %), der Schweiz (4,8 %), Tschechien (1,6 %), Russland (1,6 %) und
der Slowakei (1,6 %).
4.1 Nationale
4.1.1 Spezies und Rasse
Bei 45 der 63 Tiere (71,4 %) handelte es sich um Hunde und bei 18 Tieren (28,6 %) um
Katzen.
Bei den Hunden waren am häufigsten Mischlinge mit elf Patienten (24,4 %) und Labradore
mit vier Patienten (8,8 %) vertreten. Weiters kamen die Rassen Beagle, Briard, Deutscher
Schäferhund, Golden Retriever, Husky und Rhodesian Ridgeback mit je zwei Patienten
(4,4 %) vor. Die restlichen Hunde (40,4 %) teilten sich auf weitere 18 Rassen auf.
Bei den 18 Katzen dominierte die Europäische Hauskatze (EHK) mit elf Patienten (61,1 %),
gefolgt von Siam Katzen mit drei Vertretern (16,7 %). Die restlichen Tiere (22,2 %) teilten
sich auf weitere vier Rassen mit je einem Vertreter (5,55 %) auf.
4.1.2 Geschlecht
Insgesamt waren in dieser Studie 30 Tiere (47,6 %) weiblich und 33 Tiere (52,4 %) männlich.
Schaut man sich die Geschlechterverteilung speziesbezogen an, waren die männlichen Hunde
mit 48,9 % und die weiblichen Hunde mit 51,1 % vertreten, wobei zehn männliche Hunde
(45,5 %) und 13 weibliche Hunde (56,5 %) kastriert waren.
Bei den Katzen dominierten die männlichen Tiere mit 61,1 %. Alle 18 Katzen, egal ob
männlich oder weiblich, waren kastriert.
4.1.3 Alter
Die insgesamt 63 Tiere waren durchschnittlich 9,5 Jahre alt, wobei das jüngste Tier sieben
Monate und das älteste Tier 17 Jahre alt war.
Das durchschnittliche Alter der Hunde lag bei 9,0 Jahren mit einer Spanne von sieben
Monaten bis 17 Jahren und das der Katzen bei 10,9 Jahren, mit einer Spanne von 4-17 Jahren.
4.2 Erkrankung
4.2.1. Tumorart
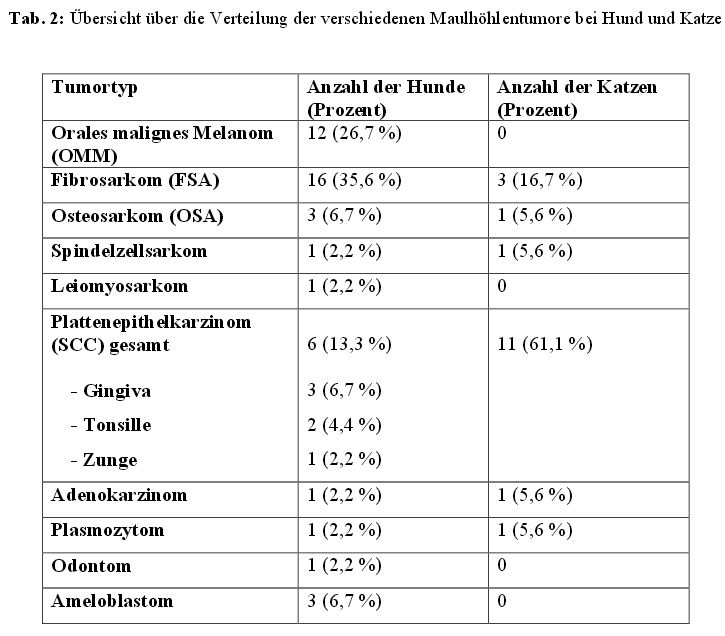
In der Maulhöhle waren bei den 45 Hunden und 18 Katzen zehn verschiedene Tumortypen zu
finden (Tabelle 2)
4.2.2. Tumorlokalisation
Die räumliche Unterteilung der Maulhöhle erfolgte in rostral und caudal, wobei hier der P2
die Grenze darstellte und alles hinter dem P2 als caudal gewertet wurde.
Bei den Hunden lagen etwas mehr als zwei Drittel (68,9 %) der Tumore in der caudalen
Maulhöhle und auch bei den Katzen dominierte diese Tumorlokalisation mit 61,1 %.
4.2.3. Knocheninvasivität
Von den insgesamt 45 Hunden zeigten 31 Tiere (68,9 %) eine Knochenbeteiligung und bei
den 18 Katzen waren es zwölf Tiere (66,7 %).
Betrachtet man zusätzlich die Lokalisation des Tumors, befand sich dieser bei 27 der
insgesamt 43 Tieren mit Knochenveränderungen (62,8 %) im caudalen und bei 16 Tieren
(37,2 %) im rostralen Bereich der Maulhöhle.
Von den verschiedenen Tumorarten dominierten, bei beiden Spezies gesamt betrachtet, mit 15
Vertretern (34,9 %) das FSA, gefolgt vom SCC mit zehn Patienten (23,3 %), dem OMM mit
sechs Patienten (13,9 %) und dem OSA mit vier Vertretern (9,3 %). Die restlichen acht
Patienten (18,6 %) erkrankten an einem Ameloblastom, Odontom, Adenokarzinom,
Leiomyosarkom oder Spindelzellsarkom.
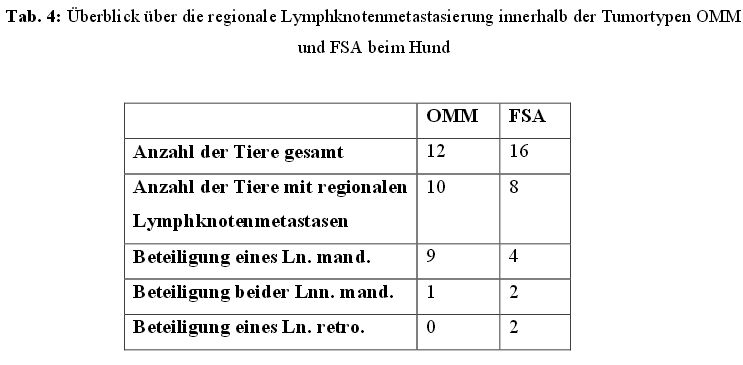
4.2.4 Regionale Lymphknotenmetastasen
Bei der Untersuchung der regionalen Lymphknoten waren bei 23 von 45 Hunden (51,1 %)
und bei fünf von 18 Katzen (27,8 %) bereits regionale Lymphknotenmetastasen festzustellen
(Tabelle 3).

Schaut man sich bei den 23 Hunden die Lymphknotenbeteiligung innerhalb der einzelnen
Tumortypen an, dominierten mit zehn Patienten (43,5 %) die OMM, gefolgt von acht Hunden
(34,8 %) mit FSA, zwei Hunden (8,7 %) mit SCC und je einem Hund (4,3 %) mit einem
Adenokarzinom, OSA und Plasmozytom (Tabelle 4).
Von den insgesamt fünf Katzen mit regionaler Lymphknotenmetastasierung waren drei Tiere
(60 %) an einem SCC erkrankt und je ein Tier an einem Adenokarzinom oder Plasmozytom.
Innerhalb der SCC und Plasmozytom Patienten, waren entweder beide oder nur ein
Mandibularlymphknoten betroffen. Die Katze mit dem Adenokarzinom hingegen zeigte eine
Beteiligung des Mandibularlymphknotens und des Retropharyngeallymphknotens einer Seite.
4.2.5 Rezidiv
Neunundzwanzig der 45 Hunde (64,4 %) wurden mit einem Ersttumor vorgestellt. Die
anderen 16 Tiere (35,6 %) kamen bereits aufgrund eines Rezidivs, wobei acht Tiere (50 %)
ein erstes Rezidiv aufwiesen, sechs Tiere (37,5 %) ein Zweites und je ein Tier (6,25 %) ein
Drittes oder Viertes.
Bei den 18 Katzen kamen 17 Tiere (94,4 %) für eine Bestrahlungstherapie des Ersttumors und
nur eine Katze aufgrund eines Rezidivs.
4.3. Kombinationstherapien
Viele der in dieser Studie betrachteten Tiere wurden nicht nur einer Bestrahlungstherapie
unterzogen, sondern erhielten auch Kombinationstherapien, wie eine chirurgische
Tumorresektion oder eine Chemotherapie, vor, nach oder auch während des
Behandlungszeitraums der Radiotherapie.
4.3.1. Chirurgische Tumorresektion
Bei 35/45 Hunden (77,8 %) wurde bereits vor Beginn der Bestrahlungstherapie eine
chirurgische Tumorresektion vorgenommen. Bei 24 dieser 35 Tiere (68,6 %) konnte jedoch
kein sauberer Schnittrand erzielt werden, weshalb sie unmittelbar nach Abheilung der OP�Wunde bestrahlt wurden. Die restlichen 11/35 Hunde (31,4 %) kamen zu einem späteren
Zeitpunkt zur Bestrahlungstherapie, aufgrund der Bildung eines Rezidivs.
Bei 2/45 Hunden (4,4 %) entschied man sich für eine präoperative Bestrahlungstherapie vor
einer chirurgischen Behandlung, um eine Verkleinerung des Tumors zu erreichen und so eine
Operation zu erleichtern oder auch erst zu ermöglichen.
Von den 18 Katzen wurden fünf Tiere (27,8 %) nach einer chirurgischen Tumorentfernung
einer Strahlentherapie unterzogen. Vier dieser Tiere (80 %) erhielten diese wieder unmittelbar
nach Resektion des Tumors und Abheilung der OP-Wunde.
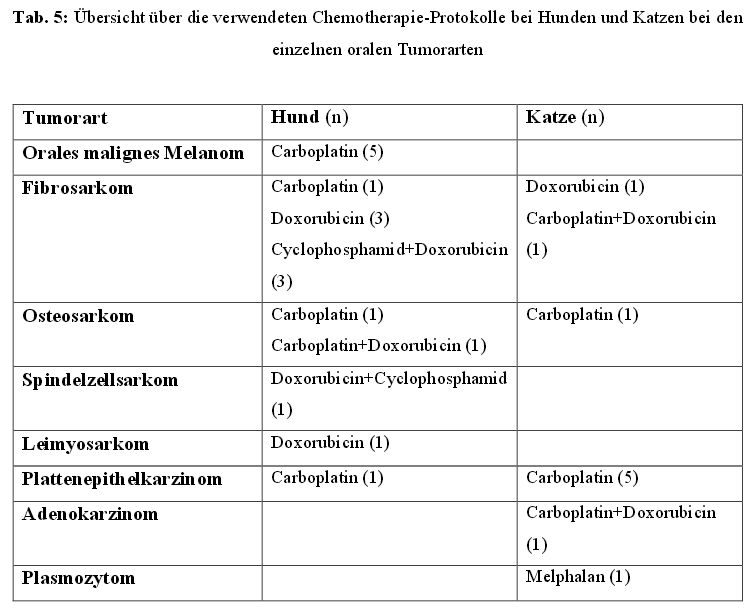
4.3.2. Chemotherapie
Neben der Chirurgie kann die Bestrahlungstherapie auch mit einer Chemotherapie kombiniert
werden. Dies ist v.a. bei Tumoren mit einer hohen Metastasierungsneigung indiziert oder
adjuvant zur lokalen Unterstützung der Radiotherapie.
In unserer Studie wurden 19/45 Hunde (42,2 %) und 10/18 Katzen (55,6 %) adjuvant mit
Chemotherapeutika behandelt. Elf der 19 Hunde (57,9 %) und eine der zehn Katzen (10 %)
erhielten diese bereits vor Beginn der Bestrahlungstherapie, acht Hunde (42,1 %) und sechs
Katzen (60 %) auch während des Behandlungszeitraumes der Radiotherapie und elf Hunde
(57,9 %) sowie neun Katzen (50 %) erst im Anschluss.
Wobei hier berücksichtigt werden muss, dass 16 der 29 Tiere (55,2 %) einer Chemotherapie
zum Teil vor und neben, vor und nach, neben und nach oder vor, neben und nach der
Bestrahlung unterzogen wurden.
Als Chemotherapeutika wurden bei den Hunden Carboplatin (52,6 %), Doxorubicin (21,1 %)
und Kombinationsprotokolle mit u.a. Cyclophosphamid verwendet.
Die insgesamt zehn Katzen wurden adjuvant mit Carboplatin, Doxorubicin oder Melphalan
behandelt, wobei Carboplatin mit 60 % dominierte (Tabelle 5).
4.4. Bestrahlungstherapie
Der Primärtumor wurde bei 18/45 Hunden (40 %) kurativ und bei 27/45 Hunden (60 %)
palliativ oder hypofraktioniert behandelt, sowie bei 100 % der Katzen palliativ.
Dabei wurde bei 21/ 45 Hunden (46,7 %) und 14/18 Katzen (77,8 %) ein makroskopisch
sichtbarer Tumor bestrahlt und bei den restlichen 24 Hunden (53,3 %) und vier Katzen
(22,2 %) ein mikroskopisches Tumorvolumen. Diese zweite Gruppe hatte schon im Vorhinein
eine chirurgische Resektion des Tumors.
Bei 8/45 Hunden (17,8 %) und 2/18 Katzen (11,1 %) wurde noch ein zweites Zielvolumen
behandelt, da betroffene regionale Lymphknoten in die Bestrahlungstherapie
miteingeschlossen wurden. Wobei dieses bei sechs Hunden (75 %) und allen Katzen (100 %)
palliativ oder hypofraktioniert bestrahlt wurde. Jedoch muss hier berücksichtigt werden, dass
es sich bei fünf dieser sechs Hunde um Patienten mit einem Oralen malignen Melanom
handelte, bei denen die regionalen Lymphknoten, aufgrund der sehr hohen
Metastasierungsneigung, immer prophylaktisch mitbestrahlt werden. Deshalb wurden auch
bei den restlichen sieben der zwölf Hunde mit einem OMM die regionalen Lymphknoten
bestrahlt, wobei diese bereits im Zielvolumen 1 mitinkludiert waren.
Der Sechste palliativ und beide kurativ behandelten Hunde waren an einem Fibrosarkom
erkrankt. Bei den Katzen wiesen beide Tiere ein Plattenepithelkarzinom auf.
Um das Bestrahlungsfeld besser einzugrenzen oder die Eindringtiefe zu variieren, wurde bei
86,7 % der Hunde und bei 94,4 % der Katzen die Bestrahlung mit einem Block, einem Cut
out oder einem Bolus modifiziert.
Zusätzlich wurde die Anzahl der Bestrahlungsfelder für das erste Zielvolumen ermittelt,
wobei in den meisten Fällen bei einer Bestrahlung mit Elektronen ein Feld und bei einer
Therapie mit Photonen zwei Felder verwendet wurden.
In dieser Studie wurden 28/45 Hunde (62,2 %) und 14/18 Katzen (77,8 %) mit einem Feld
und 17/45 Hunde (37,8 %) sowie 4/18 Katzen (22,2 %) mit zwei opponierenden Feldern
behandelt.
4.4.1. Kurative Therapie
Bei den in dieser Studie behandelten Tieren wurde nur bei den Hunden und hier bei 18/45
Tieren (40 %), ein kuratives Bestrahlungsprotokoll verwendet.
Der Primärtumor wurde dabei bei zehn Hunden (55,6 %) mit Elektronen bestrahlt, wobei bei
acht Tieren 14 Megaelektronenvolt (MeV) und bei zwei Tieren 12 MeV verwendet wurden.
Die restlichen acht Hunde (44,4 %) wurden mit 6 Megavolt (MV) Photonen bestrahlt.
In dieser kurativ behandelten Gruppe der Hunde lag die mittlere Fraktionszahl bei 15
Einheiten, die mittlere Fraktionsdosis bei 3,3 Gy und die mittlere Gesamtdosis bei 49,2 Gy.
Es wurden Protokolle mit 10 bis 16 Einzelfraktionen zu je 3,2 bis 4 Gy mit einer Gesamtdosis
von 40 bis 53 Gy verwendet.
4.4.2. Palliative Therapie
60 % der Hunde und 100 % der Katzen wurden aufgrund des Maulhöhlentumors palliativ,
beziehungsweise hypofraktioniert behandelt.
Dabei verwendete man bei 59,3 % der Hunde Elektronen mit einer minimalen Stärke von
8 MeV und einer maximalen Stärke von 14 MeV und bei 72,2 % der Katzen Elektronen mit
einer Energiespanne von 7 bis 14 MeV.
Die restlichen 40,7 % der Hunde und 27,8 % der Katzen wurden mit 6 MV Photonen
behandelt (Abb.1 und Abb.2).
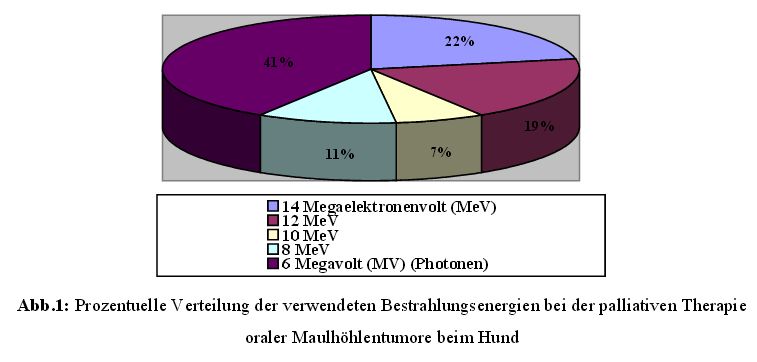
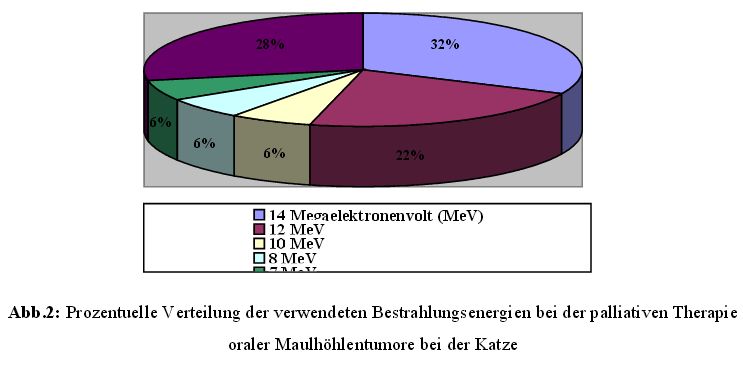
Die 27 palliativ behandelten Hunde wurden noch einmal getrennt betrachtet hinsichtlich der
Tatsache, ob sie täglich oder hypofraktioniert bestrahlt wurden.
Insgesamt erhielten 10/27 Tiere (37 %) eine tägliche Bestrahlung mit einer mittleren
Fraktionszahl von 5,3 Einheiten, einer mittleren Fraktionsdosis von 4,1 Gy und einer
mittleren Gesamtdosis von 21,5 Gy. Dabei wurden Protokolle mit 5 bis 7 Einzelfraktionen zu
je 3 bis maximal 5 Gy und einer Gesamtdosis von 20 bis 25 Gy verwendet.
Die restlichen 17/27 Tiere (63 %) wurden hypofraktioniert behandelt mit einer mittleren
Fraktionszahl von 5,4 Einheiten, einer mittleren Fraktionsdosis von 6,1 Gy und einer
mittleren Gesamtdosis von 32,6 Gy. Bei ihnen kamen Protokolle mit 3 bis 6 Einzelfraktionen
zu je 5 bis maximal 8 Gy und einer Gesamtdosis von minimal 18 bis maximal 36 Gy zum
Einsatz.
Die mittlere Fraktionszahl der Katzen lag bei 5,3 Einheiten, die mittlere Fraktionsdosis bei
4,2 Gy und die mittlere Gesamtdosis bei 22,4 Gy. Bei Ihnen verwendete man Protokolle mit
4 bis 7 Einzelfraktionen zu je 4 bis 6 Gy und einer Gesamtdosis von minimal 20 Gy und
maximal 28 Gy.
4.4.3 Akute Nebenwirkungen
Die Gradeinteilung der Nebenwirkungen von Haut und
Schleimhaut durch die
Bestrahlungstherapie erfolgte nach VRTOG (LADUE u. KLEIN, 2001).

Innerhalb der 45 Hunde zeigten sich bei 73,3 % akute Nebenwirkungen, wobei v.a. der
Grad II mit 81,8 % dominierte.
Von den 27 Hunden die einen Grad 2 aufwiesen wurden 16 Tiere (59,3 %) palliativ und elf
Tiere (40,7 %) kurativ behandelt. Wobei hier berücksichtigt werden muss, dass bei diesen
palliativ behandelten Hunden ein hypofraktioniertes Bestrahlungsprotokoll verwendet wurde.
Alle fünf Hunde mit einem Grad III wurden einem kurativen Behandlungsprotokoll
unterzogen.
Bei den Katzen wiesen nur 2/18 Katzen (11,1 %) akute Nebenwirkungen auf, wobei hier alle
Tiere palliativ behandelt wurden.
4.5 Tumorstatus nach Ende der Bestrahlungstherapie
Bei 15/21 Hunden, bei denen ein makroskopisch sichtbarer Tumor bestrahlt wurde, haben wir
Informationen im TIS über den Status des Tumors nach Ende der Bestrahlungstherapie.
Wobei bei elf Tieren der Tumor in Remission ging, bei drei Tieren blieb er stabil und bei
einem Patienten zeigte er eine Progression.
Bei den Katzen zeigte der Tumor bei acht Tieren eine Remission, bei zwei Tieren eine
Progression und bei einer Katze blieb er stabil. Bei den sieben restlichen Patienten gab es
keine Angaben im TIS.
4.6 Todesursache
Bis zum letzten Update am 30.4.2012 lebten von den insgesamt 63 Tieren noch zehn Tiere
(15,9 %), 53 Tiere (84,1 %) waren bereits verstorben.
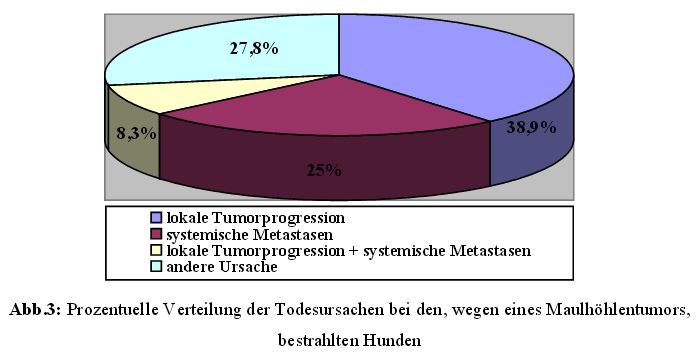
Von den 45 Hunden waren noch neun Tiere (20 %) am Leben. Bei den restlichen 36 Hunden
lag die Todesursache bei 14 Patienten (38,9 %) bei einer lokalen Tumorprogression,
neun Hunde (25 %) starben aufgrund von systemischen Metastasen, drei Tiere (8,3 %) wiesen
sowohl eine lokale Tumorprogression als auch systemische Metatastasen auf und zehn
Patienten (27,8 %) starben aufgrund einer anderen Ursache, die aber nicht tumorassoziiert war
(Abbildung 3).
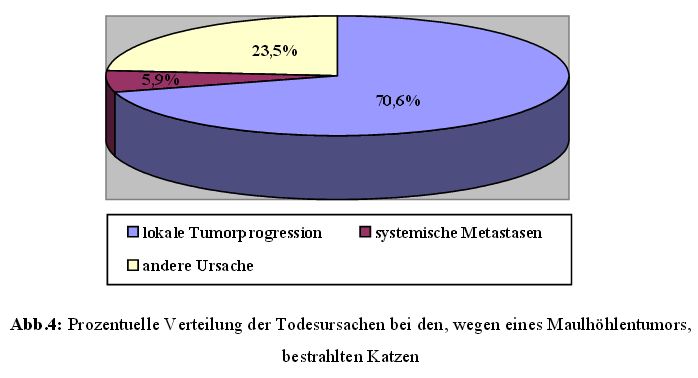
Bei den 18 Katzen waren bereits 17 Tiere (94,4 %) verstorben und nur mehr ein Tier am
Leben. Zwölf Katzen (70,6 %) starben an einer lokalen Tumorprogression, ein Patient
(5,9 %) an systemischen Metastasen und vier Patienten (23,5 %) an einer anderen nicht
tumorassoziierten Ursache (Abbildung 4).
4.7 Überlebenszeiten
Die insgesamt 63 Tiere wiesen eine mediane und mittlere Überlebenszeit von 204 und 404
Tagen auf, mit einer Spanne von elf bis 1922 Tagen (Abbildung 5).
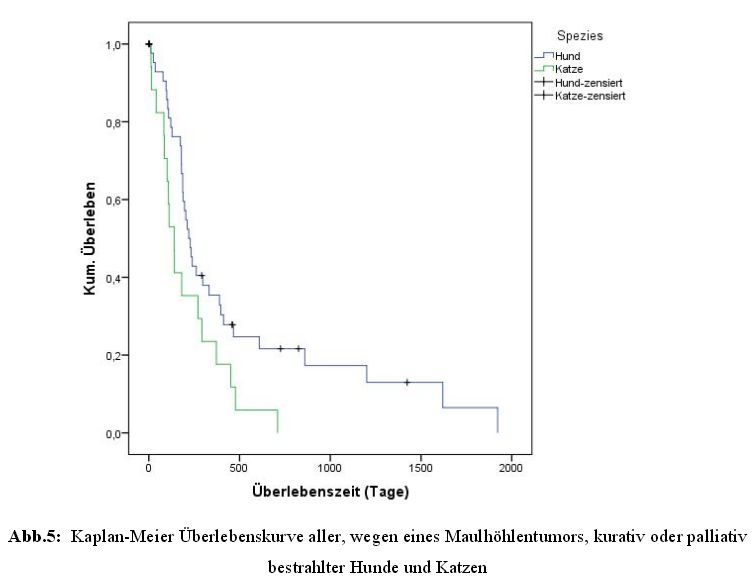
In dieser Studie wurden die Überlebenszeiten bei Hunden und Katzen hinsichtlich Faktoren
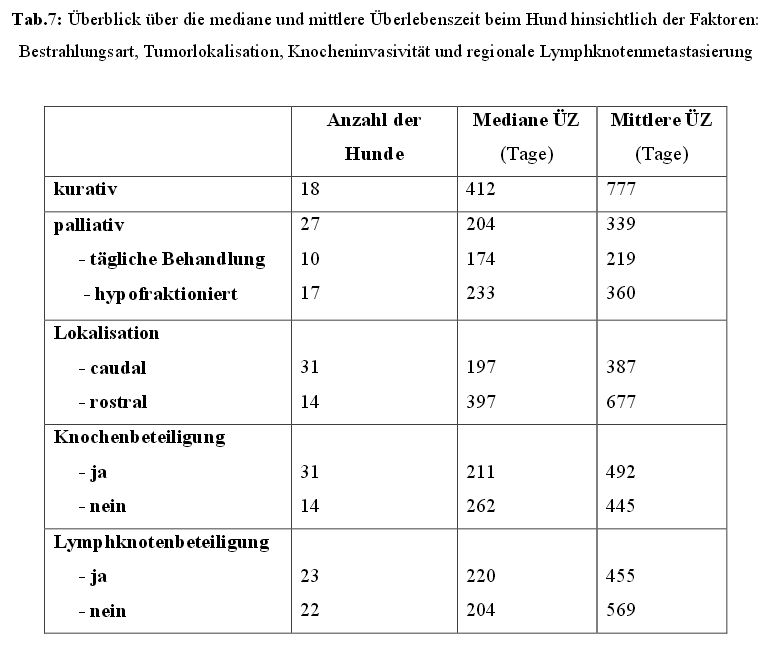
wie Bestrahlungsart, Tumorlokalisation, Knochenbeteiligung, Beteiligung der regionalen
Lymphknoten und Tumorart genauer betrachtet (Tabelle 7).
4.7.1 Überlebenszeiten der Hunde
Die mediane und mittlere Überlebenszeit lag bei den Hunden bei 220 und 491 Tagen nach
Ende der Bestrahlungstherapie, wobei es Überlebenszeiten von 11 bis 1922 Tagen gab.
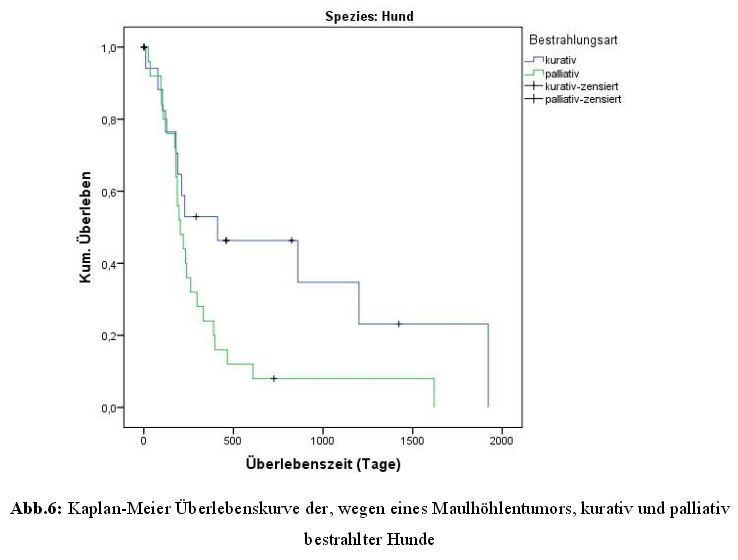
Bei den 18 kurativ bestrahlten Hunden lebte die Hälfte dieser Tiere mehr als 412 Tage mit
einer mittleren Überlebenszeit von 777 Tagen und einer Spanne von 11 bis 1922 Tagen.
Die 27 palliativ oder hypofraktioniert bestrahlten Tiere wiesen eine mediane und mittlere
Überlebenszeit von 204 und 339 Tagen auf, mit einer Spanne von 25 bis 1620 Tagen
(Abbildung 6).
Betrachtet man die palliativ bestrahlten Hunde wieder
getrennt in täglich oder
hypofraktioniert behandelt, betrug die mediane und mittlere Überlebenszeit bei den zehn
täglich bestrahlten Tieren 174 und 219 Tage und bei der hypofraktionierten Gruppe 233 und
360 Tage.
Folgende Tabelle liefert einen Überblick über die medianen und mittleren Überlebenszeiten
bei Hunden hinsichtlich der verschiedenen Faktoren: Bestrahlungsart, Tumorlokalisation,
Knocheninvasivität und regionale Lymphknotenmetastasierung.
Besonderes Augenmerk ist auf die Tumorlokalisation zu richten, da es hier zwar keine
signifikanten, aber auffällige Unterschiede in der mittleren und medianen Überlebenszeit,
zwischen rostral und caudal in der Maulhöhle gelegenen Tumoren, gibt.
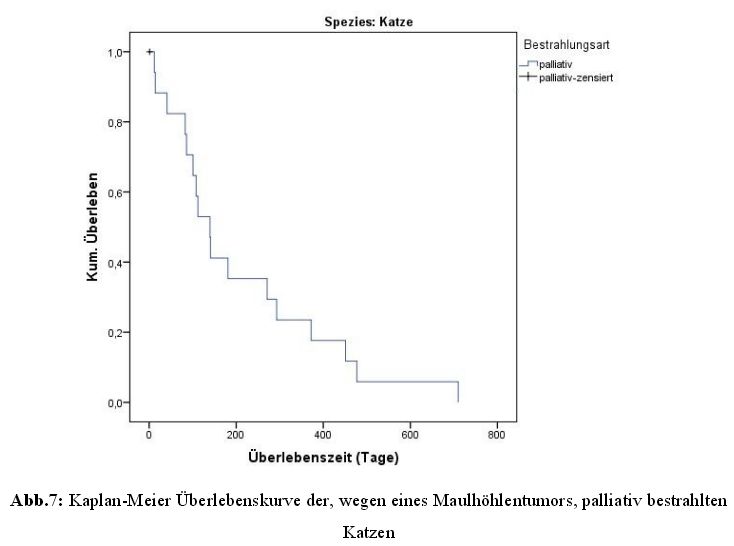
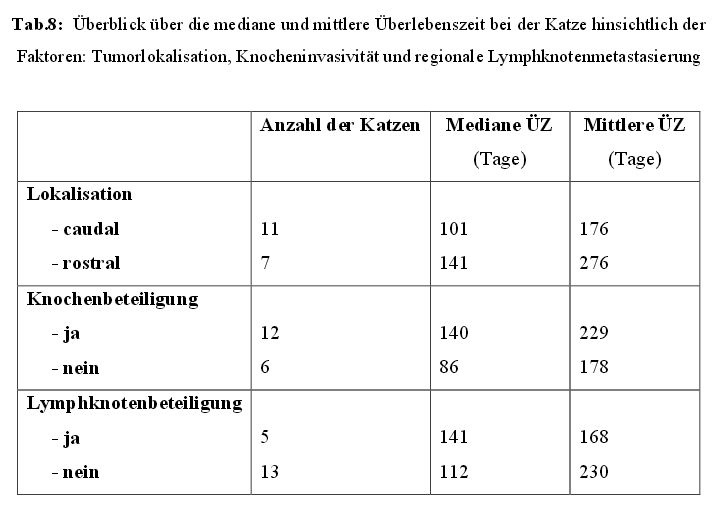
4.7.2 Überlebenszeiten der Katzen
Bei den 18 rein palliativ bestrahlten Katzen zeigte sich eine
mediane und mittlere
Überlebenszeit von 140 und 211 Tagen, mit einer Spanne zwischen 12 und 710 Tagen.
Wie in Tabelle 8 ersichtlich, wurden auch bei den Katzen die medianen und mittleren
Überlebenszeiten bezüglich der Faktoren Tumorlokalisation, Knochenbeteiligung und
regionale Lymphknotenmetastasierung genauer bestimmt. Es konnte jedoch kein signifikanter
Unterschied festgestellt werden.
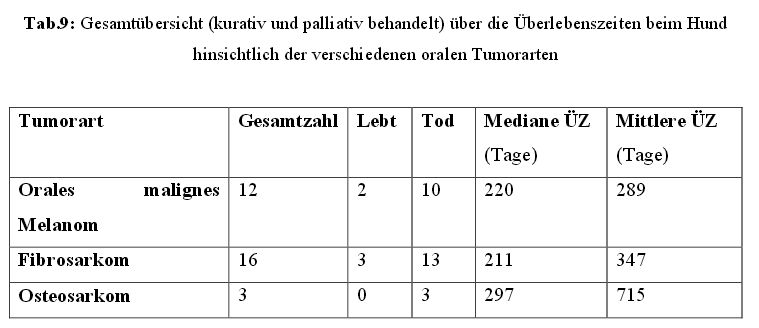
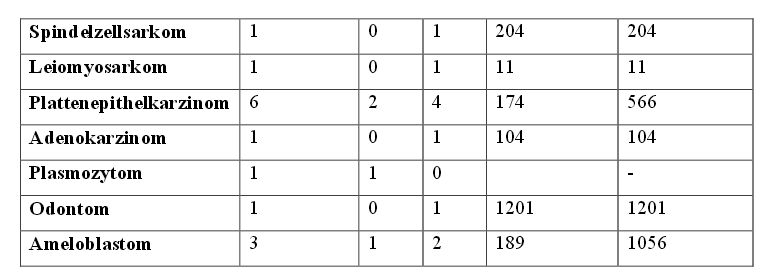
4.7.3 Überlebenszeiten innerhalb der Tumorarten
Einen Überblick über die mediane und mittlere Überlebenszeit bei den verschiedenen
Tumorarten bei Hunden und Katzen zeigen die Tabellen 9 und 10.
Da Sarkome, OMM und Karzinome bei den Hunden am häufigsten vorkamen, wurde im
Weiteren speziell auf diese Tumorarten das Augenmerk gerichtet.
21/45 (46,7 %) Hunde waren an einem Sarkom erkrankt, welches sich nochmals unterteilen
lässt in 16x FSA, 1x Leiomyosarkom, 1x Spindelzellsarkom und 3x OSA. Die mediane und
mittlere Überlebenszeit betrug 228 und 422 Tage, mit einer Spanne von 11 bis 1620 Tagen.
Bei elf dieser Patienten wurde ein kuratives Bestrahlungsprotokoll verwendet, bei zehn ein
palliatives. Außerdem befand sich bei 71,4 % der Tumor im caudalen Bereich der Maulhöhle
und 81 % wiesen eine Knochenbeteiligung auf, sowie 42,9 % eine Lymphknotenbeteiligung.
Die FSA Patienten erreichten eine mediane Überlebenszeit von 211 Tagen, die Hunde mit
einem OSA eine von 297 Tagen.
Das OMM war mit zwölf Patienten in dieser Studie vertreten,
wobei alle Tiere
hypofraktioniert behandelt wurden. Bei 66,7 % der Tiere war der Tumor im caudalen
Maulhöhlenbereich lokalisiert, 50 % wiesen eine Knochenbeteiligung auf und 83,3 % eine
Beteiligung der regionalen Lymphknoten. Die mediane Überlebenszeit betrug 220 Tage und
die mittlere Überlebenszeit 289 Tage.
Innerhalb der Karzinome wurden v.a. die sechs Hunde mit einem SCC betrachtet, welche eine
mediane und mittlere Überlebenszeit von 174 und 566 Tagen erreichten, mit einer Spanne von
95 bis1424 Tagen. Wobei hier berücksichtigt werden muss, dass vier der sechs Tiere (66,7 %)
ein palliatives und zwei der sechs Tiere (33,3 %) ein kuratives Behandlungsprotokoll
erhielten. Außerdem wiesen zwei der vier palliativ behandelten Hunde ein tonsilläres
Plattenepithelkarzinom mit bereits vorhandener Metastasierung in die
regionalen
Lymphknoten auf. Bei allen sechs Hunden befand sich der Tumor
im caudalen
Maulhöhlenbereich, wobei bei 50 % eine Knochenbeteiligung und bei
33,3 % eine
Lymphknotenbeteiligung vorlag.
Beide kurativ behandelten Patienten lebten beim letzten Update noch immer mit einer
bisherigen Überlebenszeit von 461 bzw. 1424 Tagen.
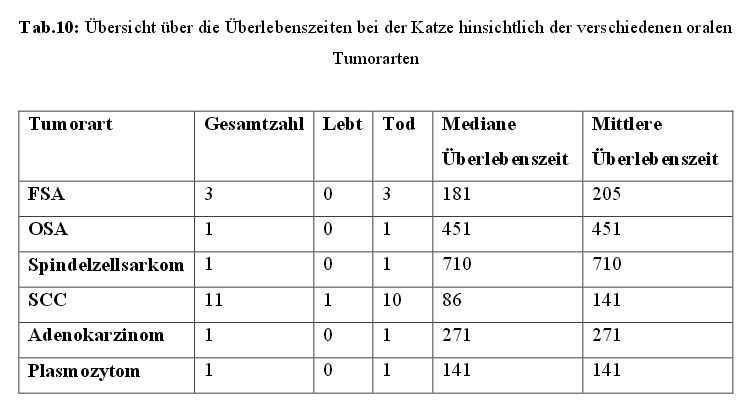
Die dominierenden Tumore der Katzen waren das SCC und das FSA.
Alle elf Katzen mit einem SCC wurden palliativ bestrahlt und wiesen eine mediane und
mittlere Überlebenszeit von 86 und 141 Tagen auf, mit einer Spanne von 12 bis 477 Tagen.
Bei acht Tieren (72,7 %) befand sich der Tumor im caudalen Bereich der Maulhöhle, 63,6 %
wiesen eine Knochenbeteiligung auf und bei 27,3 % waren die regionalen Lymphknoten
mitbetroffen.
Bei den drei Katzen mit einem FSA starb die Früheste nach 140 Tagen und die Letzte nach
293 Tagen. Die mediane und mittlere Überlebenszeit betrug 181 und 205 Tage. Alle drei
Katzen wurden palliativ bestrahlt und wiesen eine Knochenbeteiligung auf, jedoch keine
Beteiligung der regionalen Lymphknoten. Außerdem befand sich der Tumor bei 2/3 der Tiere
im rostralen Maulhöhlenbereich.
5. Diskussion
Tumore in der Maulhöhle stellen bei Hunden mit 6 % und bei Katzen mit 3 % aller Tumore
eine sehr häufige Primärlokalisation dar, da die Oberfläche der Maulhöhlenschleimhaut einer
Vielzahl karzinogener Faktoren ausgesetzt ist (CRONIN, 2006a; KESSLER, 1999e).
Leider werden sie häufig erst in einem weit fortgeschrittenem Stadium diagnostiziert,
wodurch eine chirurgische Behandlung als alleinige therapeutische Maßnahme oft nicht mehr
möglich ist. In diesen Fällen ist eine adjuvante Kombinationstherapie, am häufigsten eine
Strahlentherapie, indiziert.
In dieser Studie wurden alle Hunde und Katzen, die an der
Veterinärmedizinischen
Universität Wien im Zeitraum Jänner 2006 bis Juni 2011 aufgrund eines Maulhöhlentumors
bestrahlt wurden, retrospektiv ausgewertet mit dem Ziel
herauszufinden, ob die
Bestrahlungstherapie bei oralen Tumoren bei Hunden und Katzen die lokale Tumorkontrolle
verbessern kann.
In Österreich ist die Veterinärmedizinische Universität Wien derzeit die einzige Institution die
über einen Linearbeschleuniger verfügt. In dieser Studie wurden von insgesamt 63 Tieren
82,5 % tierärztlich zugewiesen, wobei die Mehrheit (74,6 %) der Patienten aus Österreich
stammte. Die ausländischen Patienten kamen v.a. aus Italien (15.9 %) und der Schweiz
(4,8 %). Da jedoch in diesen Ländern auch immer mehr Bestrahlungszentren eröffnen, wird
dieser Anteil in Zukunft wahrscheinlich kleiner werden. Unsere Auswertung ergab, dass der
letzte italienische Patient, der aufgrund eines Maulhöhlentumors in Wien bestrahlt wurde,
2008 überwiesen wurde.
Betrachtet man die Verteilung der Tiere speziesbezogen fällt auf, dass mit 71,4 % mehr als
doppelt so viele Hunde bestrahlt wurden wie Katzen. Dies deckt sich mit diversen Studien,
die auch von einer 2,6 mal höheren Wahrscheinlichkeit der Hunde, an oralen Tumoren zu
erkranken, berichten (LIPTAK u. WITHROW, 2007; KESSLER, 1999e).
In unserer Studie waren Mischlinge mit 24,4 % und Rassehunde mit 75,6 % in der
Patientenpopulation vertreten. Innerhalb der Rassehunde dominierten die Labradore mit
einem Gesamtanteil von 8,8 %. Grundsätzlich können orale Tumore jedoch bei jeder Rasse
vorkommen, wobei es je nach Tumorart leichte Rasseprädispositionen gibt. So kommen laut
Literatur Plattenepithelkarzinome und Fibrosarkome eher bei großen Hunderassen vor, Orale
maligne Melanome hingegen bei Dackel, Pudel Cocker und Spaniel (COYLE u. GARRETT.,
2009b; Kessler, 1999e).
Bei den Katzen geht Kessler (1999) davon aus,
dass es grundsätzlich keine
Rasseprädispositionen gibt. Auch in unserer Studie überwogen gewöhnliche europäische
Hauskatzen (61,1 %). Bei den Rassekatzen waren Siamkatzen mit 16,7 % am häufigsten
vertreten.
In den meisten älteren Studien (CRONIN, 2006a; KESSLER, 1999e; LIPTAK
u.
WITHROW, 2007) wird beschrieben, dass männliche Hunde prädisponiert sind an einem
Maulhöhlentumor zu erkranken. In unserer Studie konnten wir keine Geschlechts-
prädisposition nachweisen und hatten ein ausgewogenes Geschlechterverhältnis mit 51,1 %
weiblicher Hunde und 48,9 % männlicher Hunde. Dieses Ergebnis deckt sich auch mit einer
neueren Studie von COYLE u. GARRETT
(2009b), die ebenfalls keine
Geschlechtsprädisposition bei oralen Tumoren beobachtete.
Auch bei Katzen wird von einer gleichmäßigen Geschlechterverteilung berichtet (KESSLER,
1999e). In unserer Studie hingegen überwog der männliche Anteil mit 61,1 % leicht
gegenüber dem weiblichen Anteil.
Das durchschnittliche Alter der untersuchten Tiere lag bei 9,5 Jahren und zeigt, dass
Maulhöhlentumore grundsätzlich eher eine Erkrankung älterer Tiere darstellen. Dieses
Ergebnis passt zu anderen publizierten Studien, in denen je nach
Tumorart ein
Durchschnittsalter zwischen 7-13 Jahren berichtet wird (BERGMANN, 2010; COYLE u.
GARRETT, 2009b; KESSLER, 1999e). Jedoch darf nicht vergessen werden, dass auch immer
wieder jüngere Tiere betroffen sein können. Auch in unserer Studie lag die Alterspanne bei
den Hunden bei sieben Monaten bis 17 Jahren und bei den Katzen bei 4-17 Jahren.
Vergleicht man unsere Ergebnisse über die Häufigkeit des Auftretens der einzelnen Tumore,
stimmen die Zahlen grundsätzlich mit den Angaben in diversen Studien überein (COYLE u.
GARRETT, 2009b; CRONIN, 2006a; KLEIN, 2010).
So dominierten bei den Hunden die drei Tumorarten Orales malignes Melanom, Fibrosarkom
und Plattenepithelkarzinom. Wobei bei uns, anders als in den oben genannten Studien,
nicht die Oralen malignen Melanome an erster Stelle standen, sondern die Fibrosarkome mit
35,6 %, gefolgt von Oralen malignen Melanomen mit 26,7 % und den Plattenepithel-
karzinomen mit 13,3 %.
Laut der Studie von KLEIN (2010), stellt das Plattenepithelkarzinom mit
70 % den
dominierenden Maulhöhlentumor bei Katzen dar. Dies spiegelt sich auch bei unseren
Patienten wieder, bei denen 61,1 % an einem Plattenepithelkarzinom erkrankt waren. An
zweiter Stelle stand bei uns, sowie auch in der Literatur (CRONIN, 2006a), das Fibrosarkom
mit einem Anteil von 16,7 %.
Auch Knocheninvasivität und regionale Lymphknotenmetastasierung sind wichtige Parameter
bei der Überlegung, wie ein Tumor am besten therapiert werden kann. Ihr Auftreten hängt im
Allgemeinen sehr stark vom Tumortyp ab.
In dieser Studie wiesen 68,9 % der Hunde und 66,7 % der Katzen eine Knochenbeteiligung
auf. Die dominierenden Tumorarten mit einer Knochenbeteiligung waren Fibrosarkome
(34,9 %), Plattenepithelkarzinome (23,3 %), Orale maligne Melanome (13,9 %)
und
Osteosarkome (9,3 %).
Außerdem zeigten bei der Untersuchung bereits 51,1 % der Hunde
eine regionale
Lymphknotenmetastasierung. Bei den Katzen wiesen hingegen nur
27,8 % eine
Lymphknotenbeteiligung auf. Dies ist wahrscheinlich darauf zurückzuführen, dass 61,1 % der
felinen Tumore Plattenepithelkarzinome waren, welche eine geringe
Neigung zur
Metastasierung aufweisen (MARRETTA et al., 2007).
Unsere Ergebnisse decken sich weitgehend mit den Angaben in der Literatur.
So sind Fibrosarkome sowohl bei Hunden als auch bei Katzen dafür bekannt, dass sie lokal
invasive Tumore sind, aber eine geringe bis moderate Tendenz zur Metastasierung aufweisen
(BERGMANN, 2010; FRAZIER et al., 2011). Auch in unserer Studie zeigten 75 % der
Hunde und 100 % der Katzen eine Beteiligung des Knochens. Jedoch nur 34,8 % der Hunde
und keine an einem Fibrosarkom erkrankte Katze eine regionale Lymphknotenmetastasierung.
Innerhalb der Hunde mit einem Plattenepithelkarzinom muss man die Lokalisation des
Tumors berücksichtigen. So weisen Plattenepithelkarzinome der Gingiva durchaus eine
Beteiligung des Knochens auf, jedoch in
nur 5-10 % eine regionale
Lymphknotenmetastasierung (CRONIN, 2006a). Auch bei allen drei Hunden, die in unserer
Studie an einem gingivalen Plattenepithelkarzinom
erkrankt waren, war eine
Knocheninvasivität festzustellen, aber keine regionalen Lymphknotenmetastasen.
Plattenepithelkarzinome der Tonsillen metastasieren in der Mehrzahl der Fälle (KLEIN,
2010). Laut COYLE u. GARRETT (2009b) werden 73 % der Hunde bereits mit regionalen
Lymphknotenmetastasen vorgestellt. In unserer Studie waren zwei Hunde an einem
tonsillären Plattenepithelkarzinom erkrankt. Bei beiden Tieren waren die regionalen
Lymphknoten betroffen, im Gegensatz zu den gingivalen Plattenepithelkarzinomen aber keine
Invasivität des Knochens festzustellen.
Wie schon erwähnt, hat das Plattenepithelkarzinom bei Katzen ein niedriges Potenzial zu
metastasieren, jedoch zeigen laut einer Studie von MARRETTA et al. (2007) 70 % der
betroffenen Tiere eine Knochenbeteiligung. Dies deckt sich mit den Ergebnissen unserer
Studie, bei der bei 63,6 % der Katzen eine Knocheninvasivität und nur bei 27,3 % eine
Beteiligung der regionalen Lymphknoten festzustellen war.
Wie in einigen Studien berichtet wird, ist das Orale maligne Melanom bei Hunden ein sehr
aggressiver Tumortyp, der zum Einen mit 85-95 % ein extrem hohes Metastasenrisiko
aufweist, aber sich zum Anderen auch lokal invasiv verhält (CRONIN, 2006a; NORTHRUP,
2008a). Auch innerhalb der zwölf Hunde in unserer Studie zeigten 91,6 % bereits regionale
Lymphknotenmetastasen und 50 % eine Beteiligung des Knochens.
Natürlich sind Bestrahlungstherapien, gerade im Bereich der Maulhöhle, auch mit
Nebenwirkungen verbunden, wobei hier bei kurativen Protokollen v.a. die akuten
Nebenwirkungen dominieren (MORRIS u. DOBSON, 2001c)
Auch in unserer Studie zeigte sich bei den Hunden, dass 73,3 % akute Nebenwirkungen
aufwiesen, wobei ein Grad II nach VRTOG (LADUE u. KLEIN, 2001) mit 81,8 %
dominierte. Hier muss jedoch berücksichtigt werden, dass alle Hunde mit einem Grad II mit
aggressiven Bestrahlungsprotokollen therapiert wurden. 59,3 % dieser Hunde wurden
hypofraktioniert und 40,7 % kurativ behandelt.
Der Grad und die Art der Nebenwirkungen sind einerseits abhängig von der Lokalisation des
Bestrahlungsfeldes und andererseits von der Gesamtdosis, der Fraktionsdosis und dem
Behandlungszeitraum. Aus diesem Grund lösen aggressive Bestrahlungsprotokolle leichter
Nebenwirkungen aus (DOBSON, 1998b; SIMON, 2000a).
Diese Tatsache spiegelt sich auch in unserer Studie wieder. Denn im Gegensatz zum Hund
wiesen nur 11,1 % der Katzen akute Nebenwirkungen auf, die jedoch alle palliativ behandelt
wurden.
Grundsätzlich ist die Therapie der Wahl bei oralen Tumoren immer noch die chirurgische
Entfernung (COYLE u. GARRETT, 2009a). Jedoch spielt auch die Radiotherapie bei der
lokalen Tumorkontrolle eine sehr wichtige Rolle, gerade bei inoperablen Tumoren oder nach
einer inkompletten Tumorentfernung (NORTHRUP, 2008b).
Die Ergebnisse unserer Studie spiegeln diese Dominanz der chirurgischen Therapie wieder,
denn bei 77,8 % der Hunde wurde bereits vor Beginn der Bestrahlungstherapie eine
chirurgische Tumorresektion vorgenommen. Da bei 68,6 % kein sauberer Schnittrand erzielt
werden konnte, wurden sie unmittelbar nach Abheilung der OP-Wunde bestrahlt.
Eine präoperative Bestrahlung, um eine Verkleinerung des Tumors zu erreichen und eine
Operation so erst zu ermöglichen, wurde nur bei 4,4 % der Hunde durchgeführt. Dies zeigt,
dass bei oralen Tumoren eine präoperative Bestrahlung im Gegensatz zur postoperativen
Bestrahlung eine nur sehr geringe Rolle spielt.
Bei den Katzen erhielten nur 27,8 % eine chirurgische Tumorentfernung vor der Bestrahlung.
Dies mag daran liegen, dass Katzen eine radikale orale chirurgische Therapie nicht so gut
vertragen wie Hunde (CRONIN, 2006b).
Laut NORTHRUP (2008) wäre z.B. eine Wegnahme von > 50% der Mandibel zu aggressiv
und würde keine normale Funktion des Mauls mehr erlauben.
Des Weiteren kann man die Chirurgie, als auch die Bestrahlung, mit einer Chemotherapie
kombinieren. Dies ist v.a. indiziert bei Tumoren mit einer hohen Metastasierungsneigung, um
neben der lokalen auch eine systemische Tumorkontrolle zu erreichen (COYLE
u.
GARRETT, 2009a; CRONIN, 2006a). Auch in unserer Studie wurden 42,2 % der Hunde und
55,6 % der Katzen adjuvant mit Chemotherapeutika behandelt.
Die Ergebnisse zeigen, dass in den meisten Fällen eine Kombination
von Chirurgie,
Bestrahlung und Chemotherapie benötigt wird, um die Erkrankung längerfristig
unter
Kontrolle zu halten. Welche Kombinationen eingesetzt werden, ist jedoch abhängig vom
Tumortyp, der Lokalisation und der Ausbreitung des Tumors (COYLE u. GARRETT,
2009b).
Am Ende der Studie waren von den im Zeitraum Jänner 2006 bis Juni 2011 betrachteten
Hunden bereits 80 % verstorben, wobei die Todesursache bei 38,9 % bei einer lokalen
Tumorprogression lag.
Bei den Katzen waren es bereits 94,4 % der Tiere, wobei hier berücksichtigt werden muss,
dass alle Katzen nur ein palliatives Behandlungsprotokoll erhielten. Auch
bei ihnen
dominierte als Todesursache die lokale Tumorprogression mit 70,6 %.
Auch COYLE u. GARRETT (2009b) und KESSLER (1999e) berichteten bei nichttonsillären
Plattenepithelkarzinomen und Fibrosarkomen davon, dass Lokalrezidive meist die Ursache
für Tod bzw. Euthanasie sind. Bei tonsillären Plattenepithelkarzinomen und Oralen malignen
Melanomen hingegen dominieren als Todesursache systemische Metastasen, gefolgt von einer
lokalen Tumorprogression (COYLE u. GARRETT, 2009b)
Betrachtet man die Überlebenszeiten speziesvergleichend fällt zunächst ein signifikanter
Unterschied zwischen der medianen Überlebenszeit der Hunde (220 Tage) und der medianen
Überlebenszeit der Katzen (140 Tage) ins Auge. Dieses Ergebnis ist jedoch nicht ganz
unerwartet, da alle 18 Katzen einem rein palliativen Behandlungsprotokoll unterzogen wurden
und weiters die Mehrheit der Tumore Plattenepithelkarzinome darstellten, für welche in der
Literatur eine Überlebenszeit von etwa 2-6 Monaten angeben wird (CRONIN, 2006a). Wie
schon erwähnt, liegt hier das Ziel einer Palliation eben nicht primär bei einer Heilung oder
Verlängerung der Überlebenszeit, sondern bei einer Verbesserung der Lebensqualität und
Linderung der Schmerzen.
Welchen großen Einfluss die Art der Bestrahlung auf die Überlebenszeit hat, spiegelt sich
auch in unserer retrospektiven Auswertung wieder. Generell wird in der Literatur beschrieben,
dass aggressive Protokolle eher zu einer längerfristigen lokalen Tumorkontrolle oder sogar zu
einer Heilung führen können (SIMON, 2000a). Betrachtet
man die medianen
Überlebenszeiten der 45 in dieser Studie behandelten Hunde, kann auch hier zwischen den
kurativ (412 Tage) und palliativ (204 Tage) behandelten Tieren ein signifikanter Unterschied
festgestellt werden.
Die Parameter Knochenbeteiligung und regionale Lymphknotenmetastasierung sind zwar für
die Auswahl der richtigen Therapiemethode (Monotherapie oder Kombinationstherapie) und
der Aggressivität der Behandlung wichtige Punkte, jedoch zeigten sich in unserer Studie
hinsichtlich medianer Überlebenszeiten keine signifikanten Unterschiede.
Betrachtet man hingegen die Lokalisation des Tumors, wiesen gerade Hunde, bei denen sich
der Tumor rostral in der Maulhöhle befand, mit einer medianen Überlebenszeit von 397
Tagen deutlich längere Überlebenszeiten auf, als die Tiere, bei denen der Tumor caudal
lokalisiert war (mediane Überlebenszeit 197 Tage). Dieses Ergebnis ist zwar nicht signifikant,
deckt sich jedoch mit Angaben in älteren (KESSLER, 1999e), sowie neueren (KLEIN, 2010)
Studien. Bei diesen wird von einer besseren Prognose für rostrale Tumore berichtet, da caudal
in der Maulhöhle gelegene Tumore oft erst in einem sehr fortgeschrittenem Stadium entdeckt
werden und die radikalen chirurgischen Möglichkeiten in diesen Bereichen eingeschränkt
sind. In einer Studie von COYLE u. GARRETT (2009a) war die Wahrscheinlichkeit an der
Krankheit zu sterben 4,3 mal höher wenn der Tumor zwischen dem Canini und dem P3 lag
und sogar 5,1 mal höher, wenn er caudal des P4 lokalisiert war. Auch LIPTAK und
WITHROW (2007) berichten beim Hund mit einem rostralen Plattenepithelkarzinom von
einer medianen Überlebenszeit von 28 Monaten, bei caudalen hingegen von nur 2-10
Monaten. In unserer Studie mag eine fehlende Signifikanz auf zu geringe Patientenzahlen in
beiden Gruppen zurückzuführen sein.
Orale maligne Melanome sind bösartige, aggressive Tumore, die ohne Behandlung nur eine
mediane Überlebenszeit von 65 Tagen aufweisen (LIPTAK u. WITHROW, 2007).
Grundsätzlich ist bei einem Oralen malignen Melanom die Therapie der
Wahl die
chirurgische Entfernung des Tumors. LIPTAK und WITHROW (2007) berichten von
medianen Überlebenszeiten bei allein chirurgisch behandelten Tieren von 150 bis 318 Tagen.
Jedoch kann die Überlebenszeit verlängert werden, wenn man zusätzliche Therapien wie
Chemotherapeutika und Bestrahlung in den Behandlungsplan integriert (COYLE u.
GARRETT, 2009b; KESSLER, 1999e). Lange hat man geglaubt, dass Orale maligne
Melanome wenig strahlensensitiv sind. Behandelt man sie jedoch mit hypofraktionierten
Protokollen können gute klinische Erfolge und mediane Überlebenszeiten von 211 bis 363
Tagen erzielt werden (KESSLER, 1999e; LIPTAK u. WITHROW, 2007).
In unserer Studie wurden alle zwölf Hunde hypofraktioniert behandelt. Bei 75 % wurde
zusätzlich eine chirurgische Tumorentfernung kombiniert und bei
33,3 % eine
Chemotherapie. Mit einer erreichten medianen Überlebenszeit von 220 Tagen, stimmen
unseren Zahlen weitgehend mit den Ergebnissen in der Literatur überein.
Da, wie schon erwähnt, Orale maligne Melanome eine sehr große
Neigung zur
Metastasierung aufweisen, wurden außerdem bei allen zwölf Hunden präventiv die regionalen
Lymphknoten im ersten Zielvolumen mitbestrahlt. Auch in unserer Studie waren zum
Zeitpunkt der Diagnose bereits bei 10/12 Hunden regionale Lymphknotenmetastasen
festzustellen. Dieses Ergebnis zeigt, wie wichtig es bei Oralen malignen Melanomen ist, zu
einer chirurgischen Behandlung unbedingt Radiotherapie zu kombinieren.
Bei Hunden muss man innerhalb der Plattenepithelkarzinome unbedingt die Lokalisation des
Tumors mit berücksichtigen, da tonsilläre Plattenepithelkarzinome im Gegensatz zu
gingivalen Plattenepithelkarzinomen ein viel aggressiveres biologisches Verhalten und somit
auch eine schlechtere Prognose zeigen (COYLE u. GARRETT, 2009b; CRONIN, 2006a).
Plattenepithelkarzinome der Gingiva weisen meist eine hohe Knochenbeteiligung, jedoch eine
geringe Neigung zur Metastasierung auf, weshalb das Ziel der Therapie
die lokale
Tumorkontrolle ist und der Tumor entweder mit Chirurgie oder Radiotherapie behandelt
werden kann (CRONIN, 2006a).
LIPTAK u. WITHROW (2007) berichten von medianen Überlebenszeiten von 19 bis 26
Monaten bei Hunden nach einer Mandibulektomie und von zehn bis 19 Monaten nach einer
Maxillektomie. Werden die Tiere alleine mit einer Bestrahlung therapiert, erreichen sie
mediane Überlebenszeiten von 15 bis 16 Monaten. Kombiniert man hingegen Radiotherapie
und Chirurgie erhöht sie sich auf bis zu 36 Monaten.
Tonsilläre Plattenepithelkarzinome gehören zu den bösartigsten Tumoren beim Hund und
besitzen eine sehr ausgeprägte Metastasierungsneigung.
Weshalb die lokale
Tumorbehandlung (Chirurgie, Radiotherapie) mit einer
systemischen Therapie
(Chemotherapie) kombiniert werden sollte, um längere Überlebenszeiten zu erreichen
(KESSLER, 1999e). KESSLER (1999e) berichtete von Studien, in denen verschiedene
Therapieformen durchgeführt wurden und bei alleiniger Tonsillektomie
mediane
Überlebenszeiten von ca. zwei Monaten erreicht wurden. Kombinierte man hingegen die
Tonsillektomie mit einer Bestrahlung stieg die mediane Überlebenszeit schon auf 109 Tage
und beim Einsatz von Tonsillektomie + Bestrahlung + Chemotherapie sogar auf 240 Tage.
Obwohl in unserer Studie 83,3 % der Hunde mit einem Plattenepithelkarzinom zusätzlich zur
Bestrahlung chirurgisch therapiert wurden, erzielten wir nur eine mediane Überlebenszeit von
174 Tagen. Diese wirkt im Vergleich zu den Angaben in der Literatur sehr wenig. Jedoch
muss bedacht werden, dass 4/6 Hunde mit einem Plattenepithelkarzinom nur palliativ
behandelt wurden und 2/6 Hunde an einem tonsillären Plattenepithelkarzinom erkrankt waren.
Dass die Art der Behandlung durchaus einen großen Einfluss auf die Überlebenszeit hat
spiegelt sich in unserer Studie auch beim Plattenepithelkarzinom wieder, denn beide kurativ
behandelten Hunde lebten beim letzten Update noch immer und wiesen eine bisherige
Überlebenszeit von 461 bzw. 1424 Tagen auf.
Eine Behandlung eines Plattenepithelkarzinoms bei Katzen ist meist sehr
frustrierend.
Mediane Überlebenszeiten ohne Behandlung liegen bei ungefähr zwei Monaten, jedoch
würden sogar Monotherapien zu keiner Verbesserung führen (BERGMANN, 2010; KLEIN,
2010). CRONIN (2006a) berichtet in einer Studie, dass man mit einer Radiotherapie alleine,
vergleichbare Überlebenszeiten erzielt wie bei Tieren, die keine Therapie erhielten. Die
längsten medianen Überlebenszeiten (14 Monate) zeigen sich, wenn man eine aggressive
Chirurgie mit einer Radiotherapie kombiniert (CRONIN, 2006a; MARRETTA et al., 2007).
Da Katzen jedoch, wie schon erwähnt, eine radikale chirurgische Therapie nicht sehr gut
vertragen, muss man die Aggressivität des Vorgehens mit der verbleibenden Lebensqualität
gut abwägen. In unserer Studie wurden alle elf Katzen mit einem Plattenepithelkarzinom rein
palliativ behandelt und wiesen deshalb auch nur eine mediane Überlebenszeit von 86 Tagen
auf.
Ziel der Therapie bei Fibrosarkomen beim Hund ist die lokale Tumorkontrolle, da sie eine
geringe Neigung zu Metastasen haben. Deshalb ist die Therapie der Wahl entweder eine
Chirurgie oder eine Radiotherapie (CRONIN, 2006a). LIPTAK u. WITHROW (2007)
berichten von medianen Überlebenszeiten bei einer alleinigen chirurgischen Tumorentfernung
von elf Monaten und bei Bestrahlung als Monotherapie von sieben Monaten. Da jedoch
Fibrosarkome mit 45 % die höchste Rezidivrate aller oraler Tumore aufweisen (FRAZIER et
al., 2011; CRONIN, 2006a), sollten die Tiere unbedingt mit einer Kombination aus einer
aggressiven chirurgischen Resektion mit adjuvanter Bestrahlung
therapiert werden
(KESSLER, 1999e). Durch diese Kombinationstherapie kann laut LIPTAK u. WITHROW
(2007) die mediane Überlebenszeit auf 18 bis 26 Monate verlängert werden.
In unserer Studie wurde bei 81,3 % der Hunde vor einer Radiotherapie eine chirurgische
Resektion des Tumors vorgenommen. Dennoch wiesen sie nur eine mediane Überlebenszeit
von 211 Tagen auf, welche deutlich unter den Angaben in der Literatur liegt. Dies mag
vielleicht daran liegen, dass nur 9/16 Hunde ein kuratives Bestrahlungsprotokoll erhielten und
wir keine getrennte Analyse der kurativ bzw. palliativ behandelten Hunde vornahmen, um
nicht zu kleine Gruppengrößen auszuwerten. Innerhalb der 7/16 Hunde mit einem palliativen
Bestrahlungsprotokoll wurden 4/7 Tiere täglich fraktioniert und 3/7 Tiere hypofraktioniert
behandelt.
Fibrosarkome der Katzen zeigen das gleiche biologische Verhalten wie das der Hunde und
werden therapeutisch auch gleich behandelt. Jedoch besteht bei den Katzen das Problem, dass
sie radikale chirurgische Exzisionen sehr schlecht vertragen und es durch
die meist
inkomplette Tumorentfernung sehr schnell zu einem Rezidiv kommen wird (NORTHRUP,
2008b). Deshalb empfiehlt BERGMANN (2010) auch bei Katzen eine Kombination von
Chirurgie und Bestrahlung als Therapie der Wahl. In unserer Studie waren nur 3/18 Katzen an
einem Fibrosarkom erkrankt. Alle drei Tiere wurden nur palliativ bestrahlt, da die Tumore
zum Zeitpunkt der Diagnose als inoperabel eingestuft wurden. Dies erklärt auch eine relativ
kurze mediane Überlebenszeit von 181 Tagen.
6. Zusammenfassung
Orale maligne Tumore treten bei Hunden und Katzen sehr häufig auf und machen beim Hund
6% und bei der Katze 3% aller Tumore aus. Dass die Maulhöhle zu einer der häufigsten
Primärlokalisationen für Tumore zählt, mag daran liegen, dass die
Oberfläche der
Maulhöhlenschleimhaut natürlicherweise einer Vielzahl an karzinogenen Stoffen und
Umwelteinflüssen ausgesetzt ist (CRONIN, 2006a; MORRIS u. DOBSON, 2001c).
Viele dieser Tumore werden erst in einem sehr späten Stadium diagnostiziert, da die meisten
Besitzer keine routinemäßige Inspektion der Maulhöhle vornehmen.
In diesem
fortgeschrittenem Stadium kann eine chirurgische Tumorresektion häufig nicht mehr als
alleinige Behandlungsmöglichkeit eingesetzt werden und muss mit einer adjuvanten Therapie
kombiniert werden. Da die dominierenden Tumore in der Maulhöhle (Orales malignes
Melanom, Plattenepithelkarzinom, Fibrosarkom und Osteosarkom), mit Ausnahme der Oralen
malignen Melanome, kein hohes Metastasenrisiko aufweisen und die lokale Tumorkontrolle
im Vordergrund steht, kommt hier am häufigsten die Radiotherapie zum Einsatz (DOBSON,
1998b; LIPTAK u. WITHROW, 2007).
Ziel dieser retrospektiven Studie war es, jene Hunde und Katzen, die im Zeitraum Jänner
2006 bis Juni 2011 an der Veterinärmedizinischen Universität Wien aufgrund
eines
Maulhöhlentumors bestrahlt wurden, auszuwerten und der Frage nachzugehen, ob die
Bestrahlungstherapie die lokale Tumorkontrolle verbessern kann.
Insgesamt wurden 63 Tiere, darunter 45 Hunde und 18 Katzen betrachtet. Für alle Patienten
wurden Nationale (Name, Spezies, Rasse, Geschlecht, Alter, Gewicht), Herkunftsland und
Überweisungsstatus ermittelt. Außerdem wurden Tumorart, Tumorlokalisation, das Vorliegen
einer Knocheninvasion, regionale Lymphknotenmetasten und Krankheitsstatus (Rezidiv)
analysiert.
Die Informationen zur Tumortherapie setzten sich zusammen aus: Art der Bestrahlung,
verwendetes Behandlungsprotokoll, Kombinationstherapien, Nebenwirkungen, Tumorstatus
nach Ende der Bestrahlungstherapie, Todesursache und Überlebenszeiten.
Von den insgesamt 63 Tieren wurden 82,5 % an die Veterinärmedizinische Universität Wien
tierärztlich zugewiesen, wobei die Mehrheit der Patienten (74,6 %) aus Österreich stammte.
Es wurden mit 71,4 % mehr als doppelt so viele Hunde bestrahlt wie Katzen. Betrachtete man
die medianen Überlebenszeiten aller Tumorgruppen speziesvergleichend, ergab sich zwischen
den Hunden (220 Tage) und den Katzen (140 Tage) ein signifikanter Unterschied. Jedoch
muss hier berücksichtigt werden, dass alle Katzen rein palliativ behandelt wurden.
Bei beiden Spezies war mit einem durchschnittlichen Alter von 9,5 Jahren eine Prädisposition
älterer Tiere, an einem malignen oralen Tumor zu erkranken, festzustellen. Innerhalb der
Hunde lag eine ausgewogene Geschlechterverteilung vor, bei den Katzen hingegen überwog
der männliche Anteil leicht mit 61,1 %.
Entgegen den Angaben in der Literatur, in welchen orale Melanome
die häufigste
Tumorgruppe darstellt, dominierten bei den 45 Hunden in dieser Auswertung
die
Fibrosarkome mit 35,6 %, gefolgt von Oralen malignen Melanomen mit 26,7 % und den
Plattenepithelkarzinomen mit 13,3 %. Bei den Katzen
hingegen, stellte das
Plattenepithelkarzinom, wie auch in der Literatur (KLEIN, 2010), mit 61,1 % den häufigsten
Tumor dar.
Innerhalb der Hunde erhielten 40 % ein kuratives
und 60 % ein palliatives
Bestrahlungsprotokoll, wobei 37 % der palliativ behandelten Hunde täglich fraktioniert und
63 % hypofraktioniert bestrahlt wurden. Die Katzen wurden zu 100% mit palliativen
Protokollen behandelt. Dass die Art der Bestrahlung einen großen Einfluss
auf die
Überlebenszeiten hat, zeigte sich auch in unserer Auswertung, bei der zwischen den kurativ
(mediane Überlebenszeit 412 Tage) und palliativ (mediane Überlebenszeit 204 Tage)
behandelten Hunden ein signifikanter Unterschied festzustellen war.
Auch wenn nicht bei allen Hunden und Katzen, bei denen ein makroskopischer Tumor
bestrahlt wurde, Informationen über den Tumorstatus am Ende der Bestrahlungstherapie
vorlagen, zeigten die Ergebnisse durchaus, dass man mit Radiotherapie eine gute lokale
Tumorkontrolle erreichen kann. Bei 11/21 Hunden und bei 8/11 Katzen ging der Tumor in
Remission.
Dass die Therapie der Wahl bei Maulhöhlentumoren immer noch die Chirurgie ist, spiegelte
sich auch in unsere retrospektive Auswertung wieder. So erhielten 35/45 Hunde eine
chirurgische Tumorresektion vor Beginn der Bestrahlungstherapie.
Wie bereits erwähnt, ist es aufgrund des oft fortgeschrittenen Tumorstatus in vielen Fällen
nicht möglich, eine komplette Tumorresektion durchzuführen. Auch in dieser Studie wurde
bei 68,6 % dieser 35 Hunde kein sauberer Schnittrand erzielt, wodurch sie unmittelbar nach
Abheilung der OP Wunde zusätzlich bestrahlt wurden. Die restlichen 31,4 % kamen zu einem
späteren Zeitpunkt aufgrund eines Rezidivs zur Bestrahlungstherapie.
Bei den Hunden mit einem Oralen malignen Melanom wurde die Bestrahlungstherapie bei
75 % mit einer Chirurgie und bei 33,3 % mit einer Chemotherapie kombiniert, wodurch
mediane Überlebenszeiten von 220 Tagen erzielt werden konnten. Obwohl 83,3 % der Hunde
mit einem Plattenepithelkarzinom und 81,3 % mit einem Fibrosarkom mit einer Kombination
aus einer chirurgischen Tumorresektion und adjuvanter Bestrahlung therapiert wurden,
erzielten sie in unserer Studie mediane Überlebenszeiten von nur 174 bzw. 211 Tagen. Diese
Ergebnisse liegen deutlich unter den Angaben in der Literatur. Dies mag aber daran liegen,
dass die Mehrheit der Tiere nicht mit einem kurativen, sondern
einem palliativen
Bestrahlungsprotokoll therapiert wurden.
Zusammenfassend ist zu sagen, dass die Bestrahlungstherapie die lokale Tumorkontrolle
durchaus verbessern kann, und gerade bei knapp resezierten Tumoren zu einer Verlängerung
der Überlebenszeit führt. Die besten Ergebnisse werden erwartungsgemäß mit kurativen
Bestrahlungsprotokollen erzielt.
Da die Technik in der Bestrahlungstherapie immer weiter fortschreitet kommt es zu einer
kontinuierlichen Verbesserung der Planungsmöglichkeiten und bildlichen Darstellung des
Tumors. Dies lässt hoffen, dass in Zukunft Nebenwirkungen noch geringer werden und immer
mehr Menschen dazu bereit sind ihr Tier mit aggressiveren Bestrahlungsprotokollen
behandeln zu lassen (ESTRIN, 2009).
7. Extended Summary
Oral malignant tumors are a common tumor group in dogs and cats with an incidence rate of
about 6% in dogs and 3% in cats. The oral cavity is one of the most common primary sites for
malignant tumors. It can be explained by its large mucosal surface, which is naturally exposed
to a variety of carcinogenic substances and environmental factors (CRONIN,
2006a;
MORRIS and DOBSON, 2001c).
Many patients with oral tumors are diagnosed with advanced disease, because most owners do
not routinely inspect the oral cavity of their pet. In this advanced stage, surgical resection of
the tumor can frequently not be offered as the only treatment option and needs to be combined
with an adjuvant therapy. As the most common oral tumors (OMM, SCC, FSA and OSA) all
have a moderate to high risk of local recurrence, radiotherapy is frequently applied as
adjuvant treatment option (DOBSON, 1998b; LIPTAK and WITHROW, 2007).
The aim of this retrospective study was to evaluate the outcome in dogs and cats with an oral
tumor which have been treated with palliative or curative radiotherapy between January 2006
and June 2011 at the University of Veterinary Medicine Vienna.
A total of 63 animals, including 45 dogs and 18 cats were included into the study. For
all
animals patient characteristics (species, breed, sex, age, weight), country of origin, and
referral status were determined.
In addition, tumor type, tumor location, bone invasion, presence of regional lymph node
metastasis, and disease status (recurrence) were analysed. Treatment informations included
intent of radiotherapy, treatment protocol, combination therapies, side effects, tumor status
after radiation therapy, cause of death and survival times.
Of the 63 animals 82.5% were referred with the majority of these cases (74.6%) coming from
Austria.
Canine patients dominated the study population with 71.4%. When we compared overall
median survival times, we found a significant difference between dogs (220 days) and cats
(140 days). This difference can be explained by the circumstance that all feline patients only
received a palliative treatment. In both species the average age was 9.5 years reflecting that
typically older animals develop a malignant oral tumor. In dogs an equal gender distribution
was observed, in cats, however, the male patients dominated with 61,1%.
In contrast to most other studies in which OMM are the most common tumor type, the most
common canine oral tumors in our case series was a FSA (35,6%) followed by OMM with
26.7% and SCC with 13.3%. In the cats, however, SCC represented the most common tumor
with 61,1 % and this is consistent with the literature (KLEIN, 2010).
40% of the canine patients received, curative and 60% palliative radiation therapie. In the
palliative group 37% were radiated with a daily protocol and
63% were irradiated
hypofractionated. All cats were treated with a palliative protocol. Treatment intent had a
significant impact on survival times. In our analysis the overall median survival time in dogs
radiated with a curative protocol was 412 days and in canine patients treated palliatively it
was 204 days. Although we could not retrieve response informations from all dogs and cats
radiated with a macroscopic tumor, 11/21 dogs and 8/11 cats went into remission at the end of
therapy.
The treatment of choice for oral cavity tumors is surgery which is also reflected in our
retrospective analysis with 35/45 dogs receiving a surgical resection prior to radiation therapy.
However, surgery alone is often not feasible as a single treatment option in advanced disease.
Also in this study, in 68.6% of these 35 dogs no clean margins were reached and
postoperative radiotherapy was therefore offered. The other 31,4% of patients were radiated
came at a later time point due to recurrent disease.
In 75% of all dogs with an OMM radiation therapy was combined with surgery and in 33,3%
it was further combined with chemotherapy. The overall median survival time in this group
was 220 days which is comparable to the literature (KESSLER,
1999; LIPTAK u.
WITHROW, 2007). Although 83.3% of the dogs with a SCC and 81.3% with an FSA were
treated with a combination of surgical resection and adjuvant radiation, they achieved in our
study, median survival times of only 174 and 211 days. These results are significantly lower
than those in the literature. But this may be because the majority of the animals were not
treated with a curative, but with a palliative irradiation protocol. In conclusion radiation
therapy can improve local tumor control especially if used in a curative postoperative setting.
Modern radiotherapy with advanced imaging and planning options will further help to
minimize radiation side effects in neighbouring healthy tissue. This gives hope that in the
future more people are willing to treat their animals with aggressive irradiation protocols
(ESTRIN, 2009).
8. Literaturverzeichnis
ARGYLE, D.J., KHANNA, C. (2007): Tumor Biology and Metastasis. In: WITHROW, S.J.,
VAIL, D.M. (Eds.) Withrow & Mac Ewens’s Small Animal Clinical Oncology. 4.ed.
Saunders Elsevier, p.31-50
BERGMAN, P. (2010): Feline head and neck tumors (Proceedings).
DVM Newsmagazine 2010; 1-2
Available at: http://veterinarycalendar.dvm360.com/avhc/Medicine/Feline-head-and-neck-
tumors-Proceedings/ArticleStandard/Article/detail/746709
Accessed Sept 2, 2012
BOY, S.C., VAN HEERDEN, W.F.P., STEENKAMP, G. (2005): Diagnosis and treatment of
primary intraoral leiomyosarcomas in four dogs.
The Veterinary Record, 156, 510-513
BUCHHOLZ, J., LUDEWIG, E. (2009): Wie sinnvoll ist die Strahlentherapie bei der
Behandlung degenerativer Gelenkerkrankungen?
Der praktische Tierarzt 90, 416
CHUN, R., GARRET, L.D., VAIL, D.M. (2007): Cancer Chemotherapy –
Specific
Chemotherapeutic Agents. In: WITHROW, S.J., VAIL, D.M. (Eds.) Withrow & Mac
Ewens’s Small Animal Clinical Oncology. 4.ed. Saunders Elsevier, p.172-185.
COYLE, V.J., GARRETT, L.D. (2009a): Prognostic factors and complications associated
with surgery for oral tumors.
DVM Newsmagazine 2009; 1-2
Available at: http://veterinarymedicine.dvm360.com/vetmed/Medicine/Prognostic-factors-
and-complications-associated-wi/ArticleStandard/Article/detail/601626
Accessed Sept 2, 2012
COYLE, V.J., GARRETT, L.D. (2009b): Finding and treating oral melanoma, squamous cell
carcinoma, and fibrosarcoma in dogs.
DVM Newsmagazine 2009; 1-10
Available at: http://veterinarymedicine.dvm360.com/vetmed/Medicine/When-oral-tumors-
invade/ArticleStandard/Article/detail/601624
Accessed Sept 2, 2012
CRONIN, K.L. (2006a): Canine and feline oral tumors: Earlier is better.
DVM Newsmagazine 2006; 1-4
Available at: http://veterinarynews.dvm360.com/dvm/Medicine/Canine-and-feline-oral-
tumors-Earlier-is-better/ArticleStandard/Article/detail/360545
Accessed Sept 2, 2012
CRONIN, K.L. (2006b): Oral tumors: Know the extent of the disease prior to surgery.
DVM Newsmagazine 2006; 1-3
Available at: http://veterinarynews.dvm360.com/dvm/Medicine/Oral-tumors-Know-the-
extent-of-disease-prior-to-su/ArticleStandard/Article/detail/380873
Accessed Sept 2, 2012
DOBSON, J.M. (1998a): Tumorklassifizierung. In: WHITE R.A.S (Hrsg.) Kompedium der
Onkologie in der Veterinärmedizin. 1. Aufl. Schlütersche, Hannover, S.26-32
DOBSON, J.M. (1998b): Strahlentherapie und Hyperthermie. In: WHITE R.A.S (Hrsg.)
Kompedium der Onkologie in der Veterinärmedizin. 1. Aufl. Schlütersche, Hannover, S.164-
175
ESTRIN, L. (2009): Radiation therapy: A “ray“ of hope (Proceedings.)
DVM Newsmagazine 2009, 1
Available at: http://veterinarycalendar.dvm360.com/avhc/article/articleDetail.jsp?id=651369
Accessed Sept 2, 2012
FOALE, R., DEMETRIOU, J. (2010): Principles of cancer radiotherapy. In: FOALE, R.,
DEMETRIOU, J. (Eds.) Small Animal Oncology. 1. ed. Elsevier Limited, p.35
FRAZIER, S.A., JOHNS, S.M., ORTEGA, J., ZWINGENBERGER, A.L., KENT, M.S.,
HAMMOND, G.M., RODRIGUEZ Jr., C.O., STEFFEY, M.A., SKORUPSKI, K.A. (2011):
Outcome in dogs with surgically resected oral fibrosarcoma (1997-2008).
Vet. Comp. Oncol. 10, 33-43
GORMAN, N.T. (1998): Chemotherapie. In: WHITE R.A.S (Hrsg.) Kompedium der
Onkologie in der Veterinärmedizin. 1. Aufl. Schlütersche, Hannover, S.135-161
HAMMER, A.S. (1999): Tumore der Speicheldrüsen. In: KESSLER, M. (Hrsg.)
Kleintieronkologie. 1.Aufl. Parey, Berlin, S.300-301
KASER-HOTZ, B. (1999): Prinzipien der Strahlentherapie In: KESSLER, M. (Hrsg.)
Kleintieronkologie. 1.Aufl. Parey, Berlin, S.169-179
KESSLER, M. (1999a): Problemorientierte Diagnostik. In: KESSLER, M. (Hrsg.)
Kleintieronkologie. 1.Aufl. Parey, Berlin, S.63-72
KESSLER, M. (1999b): Prinzipien chirurgischer Onkologie. In: KESSLER, M. (Hrsg.)
Kleintieronkologie. 1.Aufl. Parey, Berlin, S.121-127
KESSLER, M. (1999c): Prinzipien der Chemotherapie. In: KESSLER, M. (Hrsg.)
Kleintieronkologie. 1.Aufl. Parey, Berlin, S.129-134
KESSLER, M. (1999d): Tumore der Haut. In: KESSLER, M. (Hrsg.) Kleintieronkologie.
1.Aufl. Parey, Berlin, S.219-254
KESSLER, M. (1999e): Tumore der Maulhöhle. In:
KESSLER, M. (Hrsg.)
Kleintieronkologie. 1.Aufl. Parey, Berlin, S.277-297
KESSLER, M. (1999f): Primäre Knochentumore der Katze. In: KESSLER, M. (Hrsg.)
Kleintieronkologie. 1.Aufl. Parey, Berlin, S.451-453
KLEIN, M.K. (2010): Oral and perianal tumors (Proceedings).
DVM Newsmagazine 2010, 1-2
Available at: http://veterinarycalendar.dvm360.com/avhc/Medicine/Oral-and-perianal-tumors-
Proceedings/ArticleStandard/Article/detail/771450
Accessed Sept 2, 2012
LaDUE, T., KAY KLEIN, M. (2001): Toxicity criteria of the veterinary radiation therapy
oncology group.
Vet. Radiol. Ultrasound. 42, 475-476
LaRUE, S.M., GILLETTE, E.L. (2007): Radiation Therapy. In: WITHROW, S.J., VAIL,
D.M. (Eds.) Withrow & Mac Ewens´s Small Animal Clinical Oncology. 4.ed. Saunders
Elsevier, p.193 -208
LIPTAK, J.M., FORREST, L.J. (2007): Soft Tissue Sarcomas. In: WITHROW, S.J., VAIL,
D.M. (Eds.) Withrow & Mac Ewens´s Small Animal Clinical Oncology. 4. ed. Saunders
Elsevier, p. 431-432
LIPTAK, J.M., WITHROW, S.J. (2007): Cancer of the Gastrointestinal Tract. Oral Tumors.
In: WITHROW S.J., VAIL D.M. (Eds.) Withrow & Mac Ewens´s Small Animal Clinical
Oncology. 4. ed. Saunders Elsevier, p. 455-472
MARRETTA, J.J, GARRETT, L.D., MARRETTA, S.M. (2007): Feline oral squamous cell
carcinoma: An overview.
Veterinary Medicine, 102, 392
McGLENNON, N.J. (1998): Das Muskel- und Skelettsystem. In: WHITE R.A.S (Hrsg.)
Kompedium der Onkologie in der Veterinärmedizin. 1. Aufl. Schlütersche, Hannover, S.260-
273
MISDORP, W. (1999): Ätiologie und Pathologie von Krebserkrankungen. In: KESSLER, M.
(Hrsg.) Kleintieronkologie. 1.Aufl. Parey, Berlin, S.3-17
MORRISON, W.B. (1998a): Gene regulation, signal transduction, and cancer.
In: MORRISON, W.B. (Ed.) Cancer in Dogs and Cats: Medical and Surgical Management.
1.ed. Williams and Wilkins, p.9-17
MORRISON, W.B. (1998b): Clinical evaluation of cancer patients. In: MORRISON, W.B.
(Ed.) Cancer in Dogs and Cats: Medical and Surgical Management. 1.ed. Williams and
Wilkins, p.63-66
MORRISON, W.B. (1998c): Selecting the best cancer treatment. In: MORRISON, W.B. (Ed.)
Cancer in Dogs and Cats: Medical and Surgical Management. 1.ed. Williams and Wilkins,
p.217-220
MORRISON, W.B. (1998d): Chemotherapy. In: MORRISON, W.B. (Ed.) Cancer in Dogs
and Cats: Medical and Surgical Management. 1.ed. Williams and Wilkins, p.351-374
MORRIS, J., DOBSON, J. (2001a): Introduction. In: MORRIS, J., DOBSON, J. (Eds.) Small
Animal Oncology. 1. ed. Blackwell Science, p.1-3
MORRIS, J., DOBSON, J. (2001b): Treatment Options. In: MORRIS, J., DOBSON, J. (Eds.)
Small Animal Oncology. 1. ed. Blackwell Science, p.34-38
MORRIS, J., DOBSON, J. (2001c): Head and Neck. In: MORRIS, J., DOBSON, J. (Eds.)
Small Animal Oncology. 1. ed. Blackwell Science, p.104-117
NAGEL, M.L. (1999): Knochentumore des Hundes. In:
KESSLER, M. (Hrsg.)
Kleintieronkologie. 1.Aufl. Parey, Berlin, S.429-438
NOLTE, M., NOLTE, I. (2000a): Ätiologie. In: NOLTE, I., NOLTE, M. (Hrsg.) Praxis der
Onkologie bei Hund und Katze. 1. Aufl. Enke Verlag, Stuttgart, S. 1-8
NOLTE, M., NOLTE, I. (2000b): Tumorklassifikation und Prognose. In: NOLTE,
I.,
NOLTE, M. (Hrsg.) Praxis der Onkologie bei Hund und Katze. 1. Aufl. Enke Verlag,
Stuttgart, S. 15-17
NOLTE, M., NOLTE, I. (2000c): Chirurgische Therapie. In: NOLTE, I., NOLTE, M. (Hrsg.)
Praxis der Onkologie bei Hund und Katze. 1. Aufl. Enke Verlag, Stuttgart, S. 53-55
NOLTE, M., NOLTE, I. (2000d): Medikamentöse Therapie. In: NOLTE, I., NOLTE, M.
(Hrsg.) Praxis der Onkologie bei Hund und Katze. 1. Aufl. Enke Verlag, Stuttgart, S. 57-76
NOLTE, M., NOLTE, I. (2000e): Tumore des alimentären Systems. In: NOLTE, I., NOLTE,
M. (Hrsg.) Praxis der Onkologie bei Hund und Katze. 1. Aufl. Enke Verlag, Stuttgart, S. 213-
222
NOLTE, M., NOLTE, I. (2000f): Tumore des Bewegungsapparates. In: NOLTE, I., NOLTE,
M. (Hrsg.) Praxis der Onkologie bei Hund und Katze. 1. Aufl. Enke Verlag, Stuttgart, S. 259-
264
NOLTE, M., NOLTE, I. (2000g): Tumore der Weichteile. In: NOLTE, I., NOLTE, M. (Hrsg.)
Praxis der Onkologie bei Hund und Katze. 1. Aufl. Enke Verlag, Stuttgart, S. 265-270
NORTH, S., BANKS, T. (2009a): The human-animal bond and why veterinary oncology is
important. In: NORTH, S., BANKS, T. (Eds.) Small Animal Oncology. 1. ed. Elsevier
Limited, p.1-2
NORTH, S., BANKS, T. (2009b): Principles of radiation oncology. In:
NORTH, S.,
BANKS, T. (Eds.) Small Animal Oncology. 1. ed. Elsevier Limited, p.45-52
NORTHRUP, N. (2008a): Update on canine melanoma (Proceedings).
DVM Newsmagazine 2008, 1-6
Available at: http://veterinarycalendar.dvm360.com/avhc/Medicine/Update-on-canine-
melanoma-Proceedings/ArticleStandard/Article/detail/563739
Accessed Sept 2, 2012
NORTHRUP, N. (2008b): Feline oral tumors (Proceedings).
DVM Newsmagazine 2008, 1-4
Available at: http://veterinarycalendar.dvm360.com/avhc/Medicine/Feline-oral-tumors-
Proceedings/ArticleStandard/Article/detail/563740
Accessed Sept 2, 2012
RUSK, A. (2005): Cancer: Cases likely will rise in aging animals.
DVM Newsmagazine 2005, 1-5
Available at: http://veterinarynews.dvm360.com/dvm/Medicine/Cancer-Cases-likely-will-
rise-in-aging-animals/ArticleStandard/Article/detail/152665
Accessed Sept 2, 2012
RUSLANDER, D. (1999): Medikamente, Dosierungen, Behandlungsprotokolle. In:
KESSLER, M. (Hrsg.) Kleintieronkologie. 1.Aufl. Parey, Berlin, S.135-146
SALISBURY, S.K. (1998a): Principle of oncologic surgery. In: MORRISON, W.B. (Ed.)
Cancer in Dogs and Cats: Medical and Surgical Management. 1.ed. Williams and Wilkins,
p.223-228
SALISBURY, S.K. (1998b): Aggressive Cancer Surgery and Aftercare. In: MORRISON,
W.B. (Ed.) Cancer in Dogs and Cats: Medical and Surgical Management. 1.ed. Williams and
Wilkins, p.269-288
SIMON, D. (2000a): Radiotherapie. In: NOLTE, I., NOLTE, M. (Hrsg.) Praxis der Onkologie
bei Hund und Katze. 1. Aufl. Enke Verlag, Stuttgart, S. 77-95
SIMON, D. (2000b): Übersicht über verwendete Chemotherapeutika. In: NOLTE, I., NOLTE,
M. (Hrsg.) Praxis der Onkologie bei Hund und Katze. 1. Aufl. Enke Verlag, Stuttgart, S. 291-
296
THRALL, D.E. (1998): Biologic Principles of Radiation Therapie. In: MORRISON, W.B.
(Ed.) Cancer in Dogs and Cats: Medical and Surgical Management. 1.ed. Williams and
Wilkins, p.399-412
VAIL, D. M. (2007): Hematopoietic Tumors – Plasma Cell Neoplasms. In: WITHROW, S.J.,
VAIL, D.M. (Eds.) Withrow & Mac Ewens´s Small animal clinical oncology. 4. ed. Saunders
Elsevier, p. 769-782
VAIL, D.M. (2009): General introduction to veterinary oncology: Myths and misconceptions
(Proceedings).
DVM Newsmagazine 2009, 1-4
Available at: http://veterinarycalendar.dvm360.com/avhc/Medicine/General-introduction-to-
veterinary-oncology-Myths
-/ArticleStandard/Article/detail/610946
Accessed Sept 2, 2012
VILLALOBOS, A. (2008): Over-treatment at a veterinary
cancer referral clinic
(Proceedings).
DVM Newsmagazine 2008, 1-4
Available at: http://veterinarycalendar.dvm360.com/avhc/Medicine/Over-treatment-at-a
-
veterinary-cancer-referral-cli/ArticleStandard/Article/detail/568389
Accessed Sept 2, 2012
WHITE, R.A.S. (1998a): Onkologische Chirurgie. In: WHITE R.A.S (Hrsg.) Kompedium der
Onkologie in der Veterinärmedizin. 1. Aufl. Schlütersche, Hannover, S.122-134
WHITE, R.A.S. (1998b): Der Magen-Darm-Kanal. In: WHITE R.A.S (Hrsg.) Kompedium
der Onkologie in der Veterinärmedizin. 1. Aufl. Schlütersche, Hannover, S.234-244
WITHROW, S.J. (2007): Why Worry about cancer in pets? In: WITHROW, S.J., VAIL,
D.M. (Eds.) Withrow & Mac Ewens’s Small Animal Clinical Oncology. 4.ed. Saunders
Elsevier, p.XV
9. Anhang
9.1 Tabellenverzeichnis
Tab.1: TNM-Klassifizierung der oralen Tumore nach WHO (NOLTE u. NOLTE, 2000)
Tab.2: Übersicht über die Verteilung der verschiedenen Maulhöhlentumore bei Hund und
Katze
Tab.3: Überblick über die Verteilung der der regionalen Lymphknotenmetastasen bei Hunden und Katzen mit oralen Tumoren
Tab.4: Überblick über die regionale Lymphknotenmetastasierung innerhalb der Tumortypen
OMM und FSA beim Hund
Tab.5: Übersicht über die verwendeten Chemotherapie-Protokolle bei Hunden und Katzen
bei den einzelnen oralen Tumorarten
Tab.6: Gradeinteilung der akuten Nebenwirkungen von Haut und Maulschleimhaut durch die
Bestrahlungstherapie bei den Hunden und Katzen
Tab.7: Überblick über die mediane und mittlere Überlebenszeit beim Hund hinsichtlich der
Faktoren: Bestrahlungsart, Tumorlokalisation, Knocheninvasivität und regionale
Lymphknotenmetastasierung
Tab.8: Überblick über die mediane und mittlere Überlebenszeit bei der Katze hinsichtlich der
Faktoren: Tumorlokalisation, Knocheninvasivität und regionale
Lymphknotenmetastasierung
Tab.9: Gesamtübersicht (kurativ und palliativ behandelt) über die Überlebenszeiten beim
Hund hinsichtlich der verschiedenen oralen Tumorarten
Tab.10: Übersicht über die Überlebenszeiten bei der Katze hinsichtlich der verschiedenen
oralen Tumorarten
9.2 Abbildungsverzeichnis
Abb.1: Prozentuelle Verteilung der verwendeten Bestrahlungsenergien bei der palliativen
Therapie oraler Maulhöhlentumore beim Hund
Abb.2: Prozentuelle Verteilung der verwendeten Bestrahlungsenergien bei der palliativen
Therapie oraler Maulhöhlentumore bei der Katze
Abb.3: Prozentuelle Verteilung der Todesursachen bei den, wegen eines Maulhöhlentumors,
bestrahlten Hunden
Abb.4: Prozentuelle Verteilung der Todesursachen bei den, wegen eines Maulhöhlentumors,
bestrahlten Katzen
Abb.5: Kaplan-Meier Überlebenskurve aller, wegen eines Maulhöhlentumors, kurativ oder
palliativ bestrahlter Hunde und Katzen
Abb.6: Kaplan-Meier Überlebenskurve der, wegen eines Maulhöhlentumors, kurativ und
palliativ bestrahlter Hunde
Abb.7: Kaplan-Meier Überlebenskurve der, wegen eines Maulhöhlentumors, palliativ
bestrahlten Katzen
9.3 Abkürzungsverzeichnis
CT
Computertomographie
DNA / DNS
Desoxyribonukleinsäure
H2O
Wasser
Ln.
Lymphonodus / Lymphknoten
Ln. mand.
Lymphonodus mandibularis
Lnn. mand.
Lymphonodi mandibulares
Ln. retro
Lymphonodus retropharyngeus
FNAB
Feinnadelaspirationsbiopsie
FSA
Fibrosarkom
1 Gray (Gy)
1 J/kg
MeV
Megaelektronenvolt
MRT
Magnetresonanztomographie
MV
Megavolt
OMM
Orales malignes Melanom
OSA
Osteosarkom
P 2,3,4
Prämolar 2,3,4
RNS
Ribonukleinsäure
SCC
Squamous Cell Carcinoma (Plattenepithelkarzinom)
TIS
Tierspitalinformationssystem
ÜZ
Überlebenszeit
VRTOG
Veterinary Radiationtherapy Oncology Group
WHO
Weltgesundheitsorganisation
Share this article / Teilen Sie diesen Artikel
Diese Webseite wurde mit Jimdo erstellt! Jetzt kostenlos registrieren auf https://de.jimdo.com